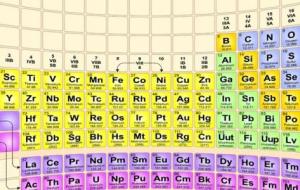
أشباه الفلزات تُعرف أشباه الفلزات (بالإنجليزية: Metalloids) على أنها مجموعة العناصر الواقعة بين الفلزات واللافلزات ، ولها خصائص وسطية بين خصائص كل من الفلزات واللافلزات، وتُبدي معظم أشباه الفلزات منظراً لامعاً وسطحاً معدنياً ولكنها في الواقع عبارة عن مواد هشة، كما تمتلك أشباه الفلزات نفس خصائص أشباه الموصلات، أما بالنسبة لموقعها في الجدول الدوري، فأشباه الفلزات تقع على طول الخط الواقع بين الفلزات واللافلزات، وتضم أشباه الفلزات كل من العناصر الآتية: البورون، والسيليكون، والجرمانيوم، والزرنيخ،
علم الكيمياء يُعرَّف علم الكيمياء بأنه العلم الذي يدرس المادة، وبنيتها المحددة كعناصر أو مركبات، وخصائصها، وكيفية تكوينها، أو فصلها، وسبب ذلك، بالإضافة إلى أنه يدرس كافة التحولات التي تمر بها المادة، والطاقة التي يتم طردها أو امتصاصها خلال تلك العمليات، وتتكون كل المواد الطبيعية والتي تمّ إنتاجها اصطناعياً على حد سواء من واحد أو أكثر من ذرات أحد العناصر المحددة، إذ تشكّل هذه الذرات اللبنة الأساسية للمواد الكيميائية على الرغم من أنها تتكون من جسيمات أولية، لذا فإن علم الكيمياء يهتم بخصائص
المادّة تُعرَّف المادة بأنها أي شيء له كتلة، ويشغل مساحة، وتتكون جميع الأجسام الفيزيائية من مادة، ويُمكن أن توجد في حالات مختلفة كالحالات الكلاسيكية للمادة وهي الصلبة، والسائلة، والغازية، بالإضافة إلى إمكانية وجودها في حالات أخرى، وهي البلازما، ومكثفات بوز- أينشتاين، وتتكون جميع المواد من الذرات، ويتحكم نوع هذه الذرات وكيفية تجميعها في تحديد خصائص المادة الكيميائية والفيزيائية، ويمكن تصنيف المادة تبعاً لطريقة تجميع الذرات فيها إلى ثلاث تصنيفات، وهي العناصر ، والمركبات، والمخاليط، ويعتمد هذا
المركبات والمخاليط يُعتبر علم الكيمياء بأقسامه وفروعه المختلفة أحد أهم العلوم المركزية والأساسية لدراسة العلوم الأخرى؛ فالكيمياء اللاعضوية تدرس خواص وتفاعلات المركبات غير العضوية، والكيمياء العضوية تدرس خواص وتفاعلات المركبات العضوية، والكيمياء الحيوية هي الكيمياء التي تدرس المواد والتفاعلات الكيميائية التي تحدث في الكائنات الحية، كما تتفرع الكيمياء الفيزيائية إلى الكيمياء الحرارية، والحركية، وكيمياء الكم، وعلم الأطياف، والميكانيكا الإحصائية، وبذلك نجد أنّ علم الكيمياء له تأثير كبير على معظم
المركّبات الهيدروكربونيّة تعد المركبات الهيدروكربونية مركبات كيميائية عضويّة تتكوّن من عناصر الكربون والهيدروجين فقط، حيث ترتبط ذرات الكربون معاً لتشكيل الهيكل للمركب، وترتبط ذرات الهيدروجين بها بأشكال مختلفة، وهي المكوّن الأساسي للنفط والغاز الطبيعي ، المستخدمان كوقود، وزيوت تشحيم، ومواد خام لإنتاج البلاستيك ، والألياف، والمطاط، والمذيبات، والمتفجرات، والمواد الكيميائية الصناعية؛ وتوجد الهيدروكربونات في الأشجار والنباتات أيضاً على شكل أصباغ يُطلق عليها اسم الكاروتينات (بالإنجليزية: carotenes)
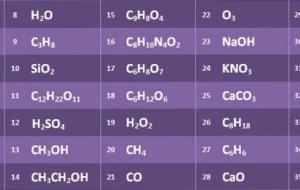
المركبات الكيميائية المركبات الكيميائية هي عبارة عن مواد تتكون نتيجة اتحاد ذرات عنصرين مع بعضهما ويكمن تحليل المركبات إلى مواد أبسط كيميائياً وفيزيائياً ومن الامثلة المحيطة بنا في الطبيعة على المركبات الماء وثاني أكسيد الكربون، كل شيء في هذا الكون الكبير يتكون من ذرات حيث يوجد أكثر من 100 عنصر كيميائي مختلف يتواجد بشكل نقي أومترابطة على هيئة مركبات كيميائية. صيغ المركبات الكيميائية الصيغة هي طريقة للتعبير عن المركبات الكيميائية ومن أشهر هذه الصيغ H2O (الماء)، CO2 (ثاني أكسيد الكربون) وNaCl
المركّبات الكيميائيّة المركّب الكيميائي وهو مادّة كيميائية تتكون من عنصرين أو أكثر بنسب معينه تحدد تركيبه، فمثلاً كلوريد الصوديوم (ملح الطعام)، فهو مركب يتكوّن من اتحاد عنصر الصوديوم (Na) مع عنصر الكلور (Cl) بنسبة 1:1، حيث يوجد المركب الكيميائي في ثلاث حالات، الحالة الغازية، أو الحالة السائلة، أو الحالة الصلبة، أمّا بالنسبة لاستخدامات المركبات الكيميائيّة، فهي تستخدم في جميع نواحي حياتنا، فمثلاً تدخّل المركّبات القاعدية في صناعة الأدوية، وفي المنظّفات المنزليّة، وفي صناعة الأسمدة، وكذلك في صنع
المركبات الكيميائية تُعرّف المركبات الكيميائيّة على أنّها مواد تكونت من اتحاد عنصرين أو أكثر بنسبة ثابتة برابطة كيميائية مثل الروابط الأيونية، والتساهمية، فعلى سبيل المثال يُعتبر ملح الطعام مركباً كيميائياً، وذلك لأنّه يتكون من اتحاد عنصريّ الصوديوم والكلور بنسبة ثابتة وهي 1:1، وتتميز المركبات الكيميائية بأنّها يمكن أنّ تتحلل لمكوناتها الأصلية عن طريق تفاعل كيميائي. أنواع المركبات الكيميائية يُوجد ما يُقارب 10 ملايين مركباً كيميائياً معروفاً، وتُصنّف جميع المُركبات الكيميائية إلى نوعين
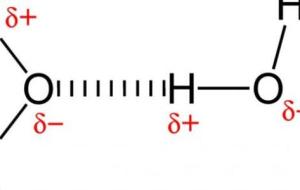
المركبات القطبيّة يعبّر مفهوم المركّب القطبيّ عن المركّب المكوّن، من جزيئات مرتبطة عبر روابط قطبيّة غير متماثلة؛ حيث تُظهر المركّبات القطبيّة خاصيّة القطبيّة؛ والتي تتميّز باحتوائها على شحنات أو أقطاب متعاكسة، والتي يمكن أن تتحوّل إلى أيونات ذائبة في الماء؛ وهو جزيء قطبيّ، أمّا المركب غير القطبيّ فيعبّر عن المركّب المتكوّن من جزيئات مرتبطة مع بعضها البعض عبر الروابط الكيميائيّة المنظّمة في طريقةٍ تجعل توزيع الشحنات متماثل، كما أنّ هذه المركبّات لا تُظهر خاصيّة القطبيّة، وبالتالي فإنّها لا
المركبات العضويّة المركبات العضويّة هي أي مركبات كيميائيّة تتميز بوجود روابط بين ذرات الهيدروجين والكربون، ويسمى العلم الذي يُعنى في دراسة هذه المركبات بعلم الكيمياء العضويّة، وتأخذ المركبات العضويّة شكلين مختلفين، فإما أن تكون على هيئة سلاسل كربونيّة طويلة ذات تركيب معين ويُطلق عليها المركبات العضويّة الأليفاتيّة، وإما على شكل هيدروكربونات أروماتيّة، وهي التي تحتوي على حلقة أو أكثر من البنزين، وعادة ما تكون غير متجانسة بحيث تتضمن الحلقة ذرات غير عنصر الكربون، ومن أمثلتها البوليمرات. تصنيف
المركّبات العضويّة المركّبات العضويّة؛ عبارة عن المركّبات الكيميائية التي تحتوي جزيئاتها على عنصر الكربون، ما عدا ثاني أكسيد الكربون، والكربونات، والسيانات، ويرجع مصطلح عضوي إلى القرن التاسع عشر، حيث اعتقد أنّ المركّبات العضويّة يتمّ تصنيعها داخل الكائنات الحية فقط خلال عمليّات تحول الطاقة، وتستخدم العديد من المركّبات العضويّة في العديد من التطبيقات، ومن أبرزها الليبيدات، والبروتينات، والكربوهيدرات، كما تلعب دوراً مهماً في علم الكيمياء الحيوية. تصنيف المركّبات العضويّة حسب الروابط مركّبات
المركّبات العضويّة تعبّر المركّبات العضويّة عن مجموعةٍ كبيرةٍ من المركّبات الكيميائيّة، وتتميّز باحتوائها على ذرّة أو أكثر من عنصر الكربون المرتبطة بذرّات العناصر الأخرى عن طريق الرابطة الكيميائيّة التشاركيّة، وغالباً ما تكون هذه الذرّات مكوّنة من عنصر الهيدروجين، أو الأكسجين، أو النتروجين، وهناك بعض المركّبات الكيمائيّة المحتوية على الكربون لكن لا تعتبر من المركبات العضوية كالكربيدات، والكروبونات، والسيانيدات. أنواع المركّبات العضويّة يُطلق على المركّبات العضوية هذا الاسم لأنّها ترتبط بأجسام
الكيمياء العضويّة Organic Chemistry يُعنى علم الكيمياء العضويّة بدراسة كل ما يتعلّق بالمركبات العضوية، من حيث بنيتها وتفاعلاتها وخواصها، ويُطلق مسمّى المركبات العضويّة على تلك المحتوية على عنصر الكربون، أو بشكل أدق تحتوي على الهيدروكربونات وهي عبارة عن خليط من عنصري الكربون والهيدروجين، وتستكشف الكيمياء العضوية مجموعة من الخصائص للمركبات العضوية وأنواع التفاعلات التي تحدث في هذه المركبات العضوية، بالإضافة إلى تصنيفاتها، وفي بحثنا هذا سنتحدث عن كل ما يتعلق بالمركبات العضويّة. المركّبات العضوية
المركبات الحلقيّة غير المتجانسة المركبات الحلقيّة غير المتجانسة (Heterocyclic compounds)، هي عبارة عن مركبات عضويّة تحتوي على ذرة كربون واحدة كحد أدنى مرتبطة بذرة مغايرة، ويعتبر النيتروجين، أو الكبريت، أو الأكسجين، من العناصر ذات القدرة الكبيرة على تكوين مركبات حلقية غير متجانسة؛ لأنّ زاوية التكافؤ في هذه العناصر قريبة جداً من زاوية التكافؤ في عنصر الكربون، وبالتالي يمكنها أن تحل محل ذرة كربون واحدة أو أكثر في نظام حلقي أروماتي أو أليفاتي شبيه بالنظام الخاص لمركب البنزين (C6H12). تتميز
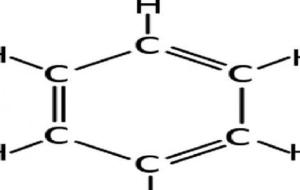
المركبات الحلقية المركّب الحلقي هو مركّب كيميائي يتكون من سلسلة من الذّرات المرتبطة مع بعضها البعض بشكلٍ حلقي، وغالبية المركبات الحلقية هي مركبات عضويّة، ولكن يوجد نسبة قليلة من المركبات الحلقية غير اضوية، ومنها: الكبريت، والسيليكون الذي يشكّل مركب السيلان، والفوسفور الذي يشكّل مركبّات الفوسفان. وتتميّز بعض أنواع المركبات الحلقية بأنّها عطرية، كمركّب البنزين. ويستخدم مفهوم المركّب متعدد الحلقات عندما يتشكّل جزيء منفرد من أكثر من حلقة واحدة كمركّب النفثالين، كما يستخدم مفهوم المركّب الحلقي
إلى ماذا تشير المركبات الأيونية؟ المركبات الأيونيّة هي التي تتكوّن نتيجة تَشارك أيونات العناصر الموجبة والسالبة للإلكترونات فيما بينها، الأمر الذي ينتج عنه تشكيل الروابط الأيونيّة، وعادةً ينتج تجاذب تلك الأيونات، من مواد بلورية صلبة تتمتّع بخواص انصهار عالية، وتتكوّن الرابطة الأيونيّة بدلاً من الرابطة التساهمية عندما يكون هنالك فرق كبير في الكهروسلبية بين الأيونات، و صيغ المركبات الأيونية المختلفة تتألف من جزئين؛ الأول هو الأيون الموجب الذي يُدعى الكاتيون، والجزء الثاني الذي يتبعه هو الأيون
المخاطر الكيميائية يشهد العالم ازدياداً كبيراً وسريعاً في عمليات صناعة وإنتاج المواد الكيميائية، بالإضافة إلى تصنيع أنواع جديدة من المركبات الكيميائية بشكلٍ سنوي، ويعد السبب في ذلك إلى التوسع الهائل في مجال الصناعة عالمياً، وبالأخص الصناعات الكيميائية، مثل: صناعات البترول، والصناعات الورقية، والصناعات البلاستيكية، والسماد والمبيدات. يمكن للمواد الكيميائية التي تستخدم في هذه الصناعات أو الناتجة عنها أن تتسبب بكوارث بيئية وصحية لمن يتعامل معها ويتعرض لها، وتعرف المخاطر التي تتسبب بها باسم
الماء كحمض وقاعدة معاً يتميز الماء بأن لديه القدرة على التصرف كحمض، وقاعدة معاً، ففي بعض الحالات يستقبل الماء بروتوناً ويتصرف كقاعدة برونستد لوري (بالإنجليزية: Bronsted-Lowry base)، كما هو موضح في المثال الآتي الذي يبين ذوبان حمض الهيدروكلوريك (HCl) في الماء:(HCl H2O(ℓ)→H3O(aq) Cl(aq وفي بعض الحالات يمنح الماء البروتون ويتصرف كحمض برونستد لوري (بالإنجليزية:Bronsted-Lowry acid)، كما هو موضح في المعادلة الآتية:(H2O(ℓ) NH(aq)→OH(aq) NH3(aq. وبالتالي فإن الماء يتصرف كحمض أو قاعدة برونستد وذلك
الماء المُقطر يُطلق مصطلح الماء المقطّر على الماء الذي تمّت تنقيته من خلال غليه حتى يصبح في الحالة الغازية ، فيبرد ويتكاثف حتى يصبح سائلاً مرة أخرى، ويختلف الماء المقطّر عن الماء المعبأ وماء الصنبور بأنه مختلف الطعم؛ وذلك لأنّ عملية التقطير تزيل الشوائب والمعادن منه، ومن الجدير بالذكر أنّ المصادر اختلفت حول فائدة تلك العملية على جسم الإنسان؛ فمنهم من يقول بأنها تساهم في تحسين صحة الجسم، والبعض الآخر يدّعي بأنها تُفقِد الجسم المعادن التي يحتاجها، ممّا يعرّضه للخطر. حالات شرب الماء المقطر بعد
الكيمياء الكيمياء هي دراسة المادة، والطاقة والتفاعلات بينهما، وهي من التخصّصات المتعلّقة بالعلوم الطبيعيّة، وتميل الكيمياء إلى التركيز على خصائص المواد والتفاعلات، ولا سيما ردود الفعل التي تنطوي على الإلكترونات، أمّا الفيزياء فتميل إلى التركيز أكثر على الجزء النووي للذرة، فضلاً عن عالم ما تحت الذرة، وسنقوم سوية بجولة بسيطة للاطّلاع على الكيفيّة التي يمكننا الاستفادة من الكيمياء فيها، كذلك على بعض الأمثلة التي تدخل الكيمياء في تفسيرها حولنا. مجالات حياتية تدخل الكيمياء فيها تساعد الكيمياء على
الكَالسيوم عنصر كيميائيّ يرمز له بالرمز Ca، وعدده الذريّ هو 20، ويقع ضمن المجموعة الثانية من الجدول الدوري، وله ستّ نظائر مختلفة، وهو من المعادن القلويّة الترابيّة، ولونه أبيض وينتج لهباً أحمر عند احتراقه، ويتفاعل مع الماء ليكوّن هيدروكسيد الكالسيوم، ويحتلّ المرتبة الخامسة من العناصر المتوافرة في الأرض، وهو عنصر مهمّ لحياة الكائنات الحيّة، كما أنّ له أهميّة صناعيّة كبيرة. استخدامات الكالسيوم في الصناعة يستخدم الكالسيوم في مجالات واسعة في الصناعة، ومنها: يكوّن المهبط في عمليّة استخلاص العديد من
النواة في لقد استطاع التطوّر التكنولوجي في مجال العلوم واختراع الأجهزة المتطورة على مساعدة الإنسان في معرفة المادة والوصول إلى أدق مكوناتها وهي النواة ، فالنواة هي التي تشكِّل الجزء المركزيّ من أي مادةٍ في الكون، وتتكون هذه النواة من البروتونات التي تحمل الشحنة الموجبة، والبروتونات متعادلة الشحنة، لتكون شحنة النواة الكلية موجبةً، وقد تم إطلاق مصطلح النيوكلون على البروتون والنيوترون معاً، ومعظم أجزاء النواة عبارة عن فراغٍ، وهناك الإلكترونات التي تدور حول النواة في مداراتٍ ثابتةٍ وتحمل الشحنة
كربونات الصوديوم كربونات الصوديوم هو مركبٌ كيميائيٌ صيغته الجزيئية هي Na2CO3، ويعرف أيضاً باسم كربونة الغسيل، يأخذ شكل البودرة البيضاء، ويوجد في الطبيعة على شكل معدن، ومحاليل كربونات الصوديوم محاليل قلوية. بيكربونات الصوديوم بيكربونات الصوديوم هو مركبٌ كيميائيٌ صيغته الجزيئية NaHCO3، وشكله مسحوقٌ بلوريٌ أبيض، ويسمى أيضاً بصودا الخبز لاستعماله في المخبوزات، يتحلل في الماء ولا يتحلل في الكحول، وعندما يسخن في وسط جاف أو في سائل فإنه يتحول تدريجياً إلى كربونات الصوديوم، وهو مركبٌ جافٌ في الهواء
الفرق بين الخل والخمر يعتبر الفرق بين الخل والخمر بسيطاً؛ فالصلة بينهما هو تفاعلٌ كيميائيٌ (تفاعل أكسدة)، وأغلب الناس لا يعرفون هذا الاختلاف، فهم فقط يعرفون أنّ الخمر محرمٌ في الدين الإسلامي، والخل محللٌ، ولكن لا يعرفون سبب التحريم والتحليل، وبالرغم من أنّ الفارق ما هو إلا تفاعلٌ كيميائيٌ، إلا أنّه يفصل الحلال عن الحرام، ولمدى أهميّة هذا الموضوع، سنطرح هنا الفرق بين الخمر والخلّ لتوعية الناس إلى الفارق بين هذين الاثنين، مع تشابه أساسهما، وسنذكر أيضاً رأي الشرع والفتاوى في هذا الموضوع. الأساس