الخصائص الكيميائية للماء يتّسم الماء بمجموعة من الخصائص الكيميائية جعلته أساس في مختلف مجالات الحياة اليومية، فلا يمكن الاستغناء عنه في مجالات كثيرة كالزراعة والصناعة، ومن هذه الخصائص ما يلي: التعادل الحمضي يعدّ الماء مادة متعادلة كيميائياً، لأنّ درجة حموضيته وقواعديته هي سبع درجات، وبهذا لا يمكن اعتباره مادة حمضية أو مادة قواعدية. الإذابة الماء يُذيب جميع المواد لأنّه مادة مقتطبة تحتوي على أيونات حرّة، فلذلك فإنّ كثيراً من الأملاح والمواد تذوب بالماء، لذا لا يوجد ماء نقي بنسبة 100% لأنّ هناء
الفولاذ يُعرَف الفولاذ بالصُّلب أيضاً، وهو عبارة عن سبيكة حديديّة تُضاف إليها نسبة تتراوح ما بين 0.2%-2.0% من عنصر الكربون وذلك وفقاً لنوع السّبيكة، ويُشار إلى أنّ الكربون هو العنصر الأساسيّ الذي تتألف منه السّبائك الفولاذيّة، وفي حال ازدياد نسبة الكربون عن 1 أو 2% سيصبح هشّاً للغاية ويُطلَق عليه مسمّى حديد زهر. يحتوي الفولاذ على نسب معيّنة من المعادن الأخرى غير الكربون، مثل: النيكل، والكروم، والسيليكون، والكبريت، وغيرها، ويؤدّي الكربون دوراً مهمّاً بمنح الفولاذ صفة الصّلابة، كما يمنع انزلاق
الفلزات وتعرف باللغة الإنجليزية بمصطلح (Metals)، وهو مشتقٌ من اللغة الإغريقية، أما تعريف الفلزات علمياً، فهي عناصر كيميائية تحتوي على مجموعة من الإلكترونات التي تكون عناصر موجبة، وسالبة تعرف باسم الأيونات، وتعرف أيضاً بأنها مجموعة من العناصر المترابطة مع بعضها البعض من أجل إنتاج كاتونات داخل نطاق من الإلكترونات. تعد الفلزات في الترتيب الأول بين مجموعات عناصر الجدول الدوري، وتعتبر العناصر التي تقع في الجهة اليُمنى هي الفلزات، أما التي توجد في الجهة اليُسرى هي اللافلزات، أما التي تقع في المنتصف
خصائص العناصر الكيميائية من أهم خصائص العناصر الكيميائية: الرقم الذري: يتخذ كل عنصر كيميائي رقماً ذرياً خاصاً به ليشير إلى عدد البروتونات بداخل نواة الذرة، وتكمن الأهمية به بتحديده لموقع العنصر في الجدول الدوري. الكتلة الذرية: ينفرد كل عنصر كيميائي بهذه الخاصة عن غيره من العناصر، وتعبر عن عدد وحدات الكتلة الذرية فيه، ويستخدم عادةً للتعبير عن عدد الجزيئات الموجودة في نواة الذرة الخاصة بكل عنصر، كما يمكن أن يشار بها إلى كافة النظائر للعناصر الكيميائية. الكهرسلبية: تكمن الأهمية في هذه الخاصية
الزئبق يعتبر الزئبق أحد العناصر الكيميائية، والتي يعود اكتشافها إلى القرن الخامس عشر الميلادي، إذ إنّه يحمل العدد الذري ثمانين في الجدول الدوريّ، ويرمز له بالرمز (Hg)، وتشير الكثير من الدراسات إلى عدم معرفة من هو مكتشف مادّة الزئبق، إلّا أنّه كان معروفاً لدى القدماء المصريين، والصينين، والهندوس، والإغريق، والرومان، حتّى سُميّ في الأساطير الرومانية القديمة (بساعي الآلهة السريع)، وذلك للخصائص التي يتمتّع بها هذا العنصر، كما ويعد عنصر الزئبق من العناصر النادر وجودها في الطبيعة حراً، ولكنّه غالباً
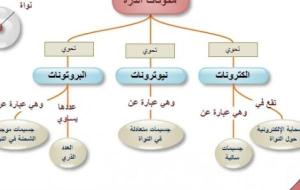
هيكلية الذرة تعرف الذرة بأنّها أصغر وحدة في المادة، وتحتوي على جميع الخصائص الكيميائيّة للعنصر، وتتكوّن من قسمين؛ القسم الأوّل هو النّواة، وتقع في مركز الذرة، وتحتوي على جسيمات موجبة تسمّى البروتونات، وجُسيمات غير مُشحونة تسمّى النيوترونات، والقسم الآخر الأكبر في الذرة يكون على هيئة غيمة من الإلكترونات السّالبة التي تدور حول النّواة، ويعد التجاذُب ما بين الشحنات الموجبة، والسالبة هو السبب في ترابُط الذرة، وإجمالاً تحتوي جميع الذرات على هذه الجسيمات الثلاثة، ويُستثنى منها الهيدروجين الذي يحتوي
خصائص البوليمرات معظم البوليمرات وخصوصاً الصناعية تتمتع بخاصيّة اللدونة وخصوصاً مع الحرارة، وهذا يعني أنّه عند القيام بتسخينها فإنّه بالإمكان إعادة تدويرها وتشكيلها مراتٍ عديدة بالإضافة لتمتعها بخصائص أخرى منها: المقاومة للمواد الكيميائية تلاحظ هذه الخصيصة في العبوات البلاستيكية التي تحتوي على مواد التنظيف، فهي شديدة المقاومة للمواد الكيميائية التي قد تسبب أضراراً كبيرة عند ملامستها لجلد الإنسان. العزل الكهربائي والحراري تستخدم البوليمرات في صناعة مقابض أواني الطبخ نظراً لكونها عازل حراري
تغيير ورق عبّاد الشمس إلى اللون الأحمر عند تجربة غمس ورق عبّاد الشمس في مادة حمضية، سيتغير لونها من الأزرق إلى الأحمر، علماً أنّ ورق عبّاد الشمس صبغ نباتي، على عكس القواعد التي تُغير لون ورقة عباد الشمس من الأحمر إلى الأزرق، كما أنّ كاشف الفينولفثالين يُصبح عديم اللون في الوسط الحمضي. الرقم هيدروجيني أقل من سبعة تكون قيمة الرقم الهيدروجيني للأحماض أقل من سبعة، وكلما كان الرقم أقل كلما زادت الحمضية، علمًا أنه يُرمز للرقم الهدروجيني بالرمز pH. ومن المعروف أنّ الرقم الهيدروجيني هو مقياس لدرجة
حمض كلور الماء هو حمض الهيدروكلوريك، ويعد محلولاً مائياً لغاز كلوريد الهيدروجين، وهو حمض معدني قوي، وهو المكون الأساسي لحمض المعدة، كما يستخدم في مجال الصناعة، وقد اكتشفه جابر بن حيان في عام 800 م، حيث استخدام في العصور الوسطى بهدف إيجاد حجر الفيلسوف، ثم استخدمه لاحقاً العديد من العلماء الأوروبيين بهدف تعلم مبادئ الكيمياء الحديثة، ثم أصبح سلعة كيميائية مهمّة في العديد من التطبيقات خلال فترة الثورة الصناعية، حيث استخدم في إنتاج العديد من المركبات العضوية، مثل كلوريد الفينيل، ولا بدّ من الإشارة
خطوات موازنة المعادلات الكيميائية فيما يأتي بعض الخطوات المتّبعة لموازنة المعادلة الكيميائية: تحديد المُتفاعلات، والنواتج، والصيغة الجزيئية لكل منهم. كتابة معادلة تتكون من جهتين؛ بحيث يتم وضع المتفاعلات قبل السهم، والنواتج بعد السهم. حساب عدد الذرات لكل عنصر في المتفاعلات، والنواتج. إذا كانت المعادلة غير موزونة فإنه يتم تغيير المُعامل الخاص بالجزيء حتى يصبح عدد الذرات لكل عنصر في المتفاعلات مُساوياً لعدد الذرات في النواتج. التحقق من عدد الذرات للتأكد من أن المعادلة موزونة. أمثلة على موازنة
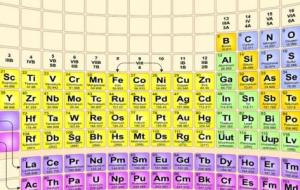
الفلزات القلوية تضم الفلزات القلويّة (بالإنجليزيّة: Alkali metals) العديد من العناصر ، وهي كالآتي: ليثيوم (Li). صوديوم (Na). بوتاسيوم (K). روبيديوم (Rb). سيزيوم (Cs). فرانسيوم (Fr). الفلزات القلوية التّرابيّة تضم الفلزات القلوية التّرابيّة (بالإنجليزيّة: Alkaline-earth metal)، وعدداً من العناصر، وهذه العناصر هي: بيريليوم (Be). مغنيسيوم (Mg). كالسيوم (Ca). سترونشيوم (Sr). باريوم (Ba). راديوم (Ra). العناصر الانتقاليّة العناصر الانتقاليّة هي العناصر التي تنتمي للمجموعات من 3-13، بالإضافة إلى
الذرة تعدّ الذرة أصغر جزء من العنصر الكيميائيّ ولا تُرى بالعين المجرّدة، ويتمّ الوصول إليها عن طريق الاحتفاظ بالخصائص الكيميائيّة للعنصر المحدّد، وترجعُ أصول كلمة ذرة إلى اللفظ الإغريقيّ أتوموس، والذي معناه غير القابل للانقسام، حيث كان يعتقد أنّه لا يوجد شيء أصغر من الذرة، وتتألف الذرّة من سحابة من الإلكترونات السالبة التي تدورُ حول نواة موجبة الشحنة وصغيرة في المركز، ونيوترونات متعادلة، وبروتونات موجبة الشحنة. تكوين الذرة تتكوّن الذرة من جسيْمات تحت ذريّة مختلفة، وتتكوّن من: البروتون
غاز الميثان غاز الميثان أحد أنواع الوقود المهمَة، وهو من أبسط أنواع الألكانات أي الهيدروكربونات، وصيغته الكيميائيّة هي (CH4)، وينتج مركّبه الكيميائيّ من ترابط أربع ذرّاتٍ من الهيدروجين مع ذرّةٍ واحدةٍ من الكربون، وهو جزيءٌ طبيعيٌّ مستقرٌ جدّاً، وغاز الميثان النقيِّ ليس له لون ولا رائحة، ويعدُّ أقلَّ كثافةً من الهواء الجوِّيّ، كما أنّه غازٌ قابلٌ للاشتعال. عند الاستخدام التجاريّ للميثان تُضاف إليه كميّاتٌ ضئيلةٌ من مركّبات الكبريت ذات الرائحة المميّزة والقويّة، مثل: مركّب إيثيل مركبتان؛ وذلك
علم الكيمياء Chemistry هو العلم الذي يهتم بالدراسة التفصيليّة للعنصر والمادة الكيميائيّة، والتطرّق إلى خواصها وسلوكها والتفاعلات التي تطرأ عليها، وبنيتها، وتركيبها، وكل ما يتعلق بالمادة من تغيّرات، ويُطلق عليه أيضاً اسم العلم المركزيّ؛ نظراً لجمعه أكثر من نوع لأنواع العلوم كالفيزياء وربطها مع العلوم الطبيعيّة، وربط علم الأحياء وعلم الفلك والجيولوجيا. أقسام الكيمياء الأساسية الكيمياء التحليليّة: يهتم هذا النوع الكيمياء بدراسة التركيب الكيميائيّ للمادة، وكيفيّة بناء هذا التركيب من خلال أخذ
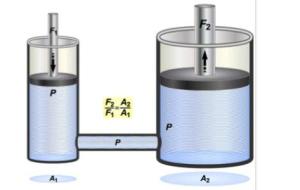
الضغط يعرّف الضغط على أنّه التأثير الذي يحدث عند وقوع قوةٍ عموديةٍ على سطحٍ أو مساحةٍ معينة ويرمز له بالرمز ض أو P، كما يعدّ الضغط كميةً قياسيةً لها وحدةٌ محددةٌ في النظام الدوليّ تسمى باسكال وحيث إنّ واحد باسكال يساوي واحد نيوتن على مترٍ مربع، كما يعدّ الضغط من الإحداثيات الرئيسية، في ما يسمّى بالديناميكية الحرارية، كما أنّه مقترنٌ دائماً بالحجم. ضغط السائل ضغط السائل أو كما يسمّى أيضاً بالضغط في الموائع الساكنة يعرّف على أنه وزن عمود السائل الذي مساحةُ مقطعهِ وحدةُ المساحاتِ المحيطة بنقطةٍ
تعريف المادّة العضويّة يُطلَق مصطلح المادّة العضويّة على المواد التي تتكوّن بأساسها من الكربون، وتنتشر هذه المواد بالطبيعة بشكل كبير، فهي تشكّل البروتينات، والكربوهيدرات، والدهون، والأحماض النوويّة وغيرها، كما ويمكن وصف مخلّفات الكائنات الحيّة بأنّها عضويّة، كبقايا النباتات المتحلّلة أو المواد المتحلّلة من الحيوانات، حيث تنتقل هذه المخلّفات بصورة أو بأخرى إلى التربة لتشكّل مصدراً لتغذيتها. تأثير المواد العضوية على التربة تمتلك المواد العضويّة تأثيراً إيجابيّاً على التربة من عدّة نواحٍ، ومن
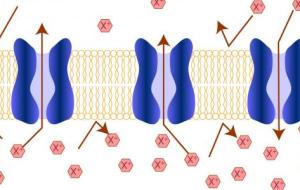
تعريف الضغط الإسموزي يعرّف الضغط الإسموزي بأنّه الضغط الذي ينتُج عن حركة ذرات أو أيونات السائل المُذاب من منطقة تتميز بتركيزها المنخفض للمُذاب فيها إلى منطقة أخرى ذات تركيز أعلى من المُذاب، مُسببةً اختلافاً في تركيز المحاليل على جانبي الغشاء البلازمي، ويُطلق على الضغط الإسموزي أيضاً بالضغط التناضحي. حالات تغيّر الخلية في الضغط الإسموزي هنالك عدّة حالات تتغير بها الخلية نتيجةً لتغير الضغط الأسموزي مما يؤثر عليها، وفيما يأتي شرح لهذه الحالات: الحالة الأولى: تحدث هذه الحالة عندما تتواجد الخلية في
المرحلة الأولى للجدول الدوري تطور الجدول الدوري (بالإنجليزية: Periodic Table) بين عامي 1789-1862م على النحو الآتي: عام 1789م: وضع العالم الكيميائي الفرنسي أنطوان لافوازييه (Antoine Lavoisier) القائمة الأولى للمواد التي لا يُمكن تقسيمها أكثر، مثل: أكسيد المغنيسيوم (Magnesia)، والباريت (Barytes)، لكنه استبعد الصودا، والبوتاس؛ لأنّه كان يعتقد أنّه يُمكن تقسيمها أكثر. عام 1805م: ظهر الجدول الدوري لأول مرة بواسطة العالم جون دالتون (John Dalton) الذي صنف العناصر بناءً على الكتل الذرية. عام 1807م:
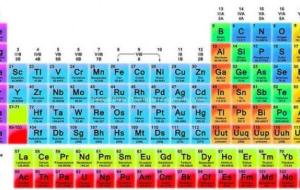
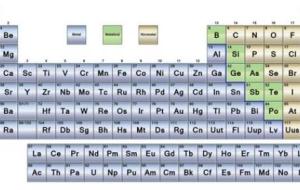
الجدول الدوري يعتبر الجدول الدوري من أهم الأدوات المستخدمة في الكيمياء، وفي العلوم الأخرى، وهو عبارة عن جدول ترتب فيه العناصر الكيميائيّة بشكل منطقي ومفيد، لتسهيل عمليّة دراستها، وتصنّف العناصر في الجدول الدوري وفقاً لزيادة أعدادها الذرية، بحيث يزيد كل عنصر عن العنصر الذي يسبقه بإلكترون واحد. كما تترتب العناصر المتماثلة في الخصائص الكيميائيّة والفيزيائيّة بنفس الصف، أو في نفس العمود مع بعضها البعض، لذلك سمي بالجدول الدوري، لأنّ الصفات تتكرر بشكل دوري، على سبيل المثال، يزداد الحجم الذرّي من
الجدول الدوري الجدول الدوري للعناصر أو جدول مندليف هو عرض للعناصر الكيميائيّة التي تمّ اكتشافها عبر العصور، وتعود هذه الطريقة المتبعة في ترتبيه إلى العالم الروسي ديمتري مندليف جيث قام بتصنيفه في الفترة ما بين عامي 1869م و1870م، حيث قام بالعديد من الحسابات التي توضح كتل العناصر ودوريتها، ثم رتبها بالاعتماد على هذ الحسابات على التوالي، ومع مرور الوقت أضيفت إليه مجموعة من العناصر التي تمّ اكتشافها لاحقاً ليصبح بهذا الشكل الحالي. تصنيف العناصر في الجدول الدوري يحتوي الجدول الدوري الحالي على مئة
التفاعلات الكيميائية للتفاعلات الكيميائية أثر كبير في حياتنا، فبدونها لا يمكنك لأي عملية أن تتم، فمثلاً السيارة تحتاج لتفاعل الجازولين عن طريق الإحتراق لتسير السيارة، وكذلك النبات والإنسان والحيوان، وجميع العمليات الحيوية والكيميائية على سطح الأرض، و إن ما يحدث عند تفاعل العناصر مع المركبات ما هو إلا كسر للروابط الكيميائية في المواد المتفاعلة وبالتالي تكوين روابط جديدة، أي بمعنى آخر: تفكك أو انحلال مواد، وتكوُّن مواد جديدة من الأجزاء المتفككة. ولتسهيل دراسة التفاعلات الكيميائية وما يحدث فيها
تسمية المركبات الكيميائية يُعدّ إنشاء اسم لأي مركب كيميائي علماً دقيقاً ومهمًا في مجالات علوم الكيمياء، إذ إنّ الاسم ليس مجرد مصطلح يُطلق على المركب، بل هو مصطلح مُرتّب بدقة يُسهّل على الكيميائيين معرفة التركيب الدقيق للمركب أثناء قراءته، كما يستخدم نفس الاسم الذي يُطلق على المركب في جميع أنحاء العالم الكيميائي، ويجب أن يُترجم بسهولة لجميع اللغات لتجنّب الأخطاء التي قد تحدث خلال الترجمة، فهذه الأخطاء غير مقبولة نظراً لأنّ بعضها قد يُؤدّي نتائج خطيرة، ويجدر بالذكر أنّ عملية تسمية المركب تمرّ
تسمية المركبات العضوية تعتبر الكيمياء العضوية من أهم فروع علم الكيمياء، إذ تدرس العديد من المركبات التي نستخدمها يومياً في حياتنا، من حيث كيفية تركيبها الكيميائي، وأثرها على البيئة، ويطلق عليها اسم المركبات العضوية. إنّ المركبات العضوية تحتل الصدارة في حياتنا من ناحية العدد، والأهمية، فهي أكثر بكثير من المركبات غير العضوية، وقد قدر عددها بعشرة ملايين مركب، مقارنة بنصف مليون مركب فقط من المركبات غير العضوية، ويرجع وجود هذا الكم الهائل من المركبات العضوية في حياتنا لقدرة ذرة الكربون على الارتباط
تحضير محلول قياسي المحلول القياسي (بالإنجليزية: standard solution) هو المحلول الذي يعرف تركيزه بدقة، وهناك عدة طرق لتحضيره كما يأتي: التحضير بطريقة الوزن يمكن تحضير المحلول القياسي من خلال اتباع الخطوات الآتية: حساب ووزن كتلة المذاب المراد تحضير محلول له. إذابة المذاب في الماء المقطر في دورق. نقل المحلول إلى دورق حجمي وإضافة الماء المقطر حتى يصل إلى الحجم المطلوب، ثم يتم تحريكه بالهزّ. مثال للتوضيح: عند تحضير محلول تركيزه 1 مولار من كلوريد الصوديوم (NaCl)، وحجمه 1 لتر، يتم اتباع الخطوات