المحاليل الكيميائية في علم الكيمياء تُقسم المادة إلى ثلاثة أقسامٍ رئيسيةٍ هي الجامدة والسائلة والغازية؛ والمادة السائلة من أهم تقسيماتها المحاليل المحاليل الكيميائية هي نوعٌ من المواد الكيميائية تنتج من عملية خلط أو إذابة لمادةٍ أو أكثر في مادةٍ أخرى. وتقسم المحاليل إلى ثلاثة أقسامٍ رئيسية: المحلول المُعلَّق: هو محلولٌ غير متجانس، ينتج من إذابة مادة في أخرى بحيث تكون جزيئات المادة المذابة كبيرة ويمكن تمييزها بالعين المجردة، وتُفصل بالترشيح أو الترويق؛ مثال الكبريت في الماء، النشا في الماء.
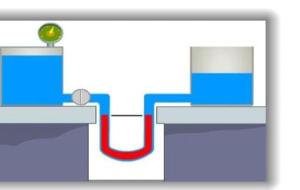
السوائل والغازات إنّ السوائل والغازات هي المواد التي تنساب في حالة التأثير عليها بقوّة مؤثّرة، وتأخذ شكل الوعاء الذي تخزّن فيه، ويطلق عليهما معاً اسم المائع، كما يوجد في علم الفيزياء مائعٌ مثاليٌ؛ وهو مائعٌ غير موجود حقيقةً بل هو افتراضيٌ وُضع من قِِبل العلماء لتسهيل دراسة العلوم الخاصّة بالموائع وحل المسائل الرياضيّة، ولهذا المائع خصائص عدّة فهو غير قابل للانضغاط، ومنتظم السريان، ولزوجته تساوي صفراً، أي لا توجد قوى احتكاك بين جزيئاته. ضغط السوائل والغازات أو الموائع هناك نوعان من الموائع، هي
الضغط يعبّر الضغط عن القوة العمودية المؤثرة على وحدة المساحة، ويُمكن التعبير عنه رياضياً (ض= ق/أ)، حيث إنّ وحدة القوة هي نيوتن ووحدة المساحة هي م وذلك حسب النظام العالمي للوحدات وبالتالي تكون وحدة الضغط هي نيوتن/م وتُسمى الباسكال، ويعبّر الباسكال عن الضغط المتولّد عن قوّة مؤثّرة مقدارها 1 نيوتن تؤثر عمودياً في وحدة مساحة مقدارها متر مربّع. العوامل المؤثرة في الضغط يُمكن استنتاج العوامل التي تؤثّر على قيمة الضغط من خلال قانونه السابق، إذاً إنّ العوامل المؤثرة على الضغط هي القوة والمساحة؛ حيث
المادة تعرّف المادّة في الفيزياء الكلاسيكيّة على أنّها كل شيء له كتلة وحجم، ولكل مادّة خصائص خاصّة بها كالحجم والكتلة والكثافة، وتكوّن المواد جميعها الكون الذي نعيش فيه، فالمادّة هي جزء من الكون، حيث تشكّل 27% من كتلة الكون، و4% فقط هي المادّة الطبيعية، والتي تنقسم إلى نوعين، وهما: المادّة المضيئة، والمادّة غير المضيئة. صفات المواد للمادة صفات عدة منها: حالة المادّة: وهي صفة المادّة التي توضّح طريقة تراكم الجسيمات المكوّنة لها، وتقسّم إلى ثلاثة أنواع، هي: الحالة الغازيّة ، والحالة السائلة،
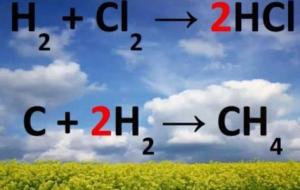
المعادلة الكيميائية المعادلة الكيميائية عبارة عن طريقة لكتابة التّفاعل الكيميائيّ، وتمثيله، والتعبير عنه باستخدام رموزٍ وصيغٍ كيميائية، بحيث تُبيّن المواد الدّاخلة في التّفاعل، والمواد الخارجة منه، كما تُبين الإلكترونات المُكتسبة أو المَفقودة من كلِّ ذرةِ عنصر من عناصر التّفاعل. مثال على معادلة كيميائية من الأمثلة على المعادلات الكيميائية القول مثلاً بأنّ غاز الميثان يتفاعلُ مع غاز الأكسجين، وينتج من ذلك التّفاعل غاز ثاني أكسيد الكربون والماء، أو يمكن كتابتها على شكل معادلة كيميائية بوضع رمز
معدل سرعة التفاعل معدل سرعة التفاعل (بالإنجليزية: reaction rate) هو عبارة عن السرعة التي يتقدم فيها التفاعل الكيميائي، والتي يتمّ التعبير عنها عادةً بأنها تركيز المواد الناتجة في وحدة الزمن أو تركيز المواد المتفاعلة المستهلكة في وحدة الزمن. قانون معدل سرعة التفاعل يتم التعبير عن قانون معدل سرعة التفاعل الكيميائي للمعادلة (A B→ C) كما يأتي: معدل التفاعل= التغير في التركيز/ التغير في الزمن. معدل التفاعل للمادة A= - التغير في تركيز المادة A/ التغير في الزمن. معدل التفاعل للمادة B= - التغير في
الفلزات القلويّة التّرابية مجموعةٌ من العناصر تتواجد في المجموعة الثانية من الجدول الدوريّ، وهي: بيريليوم(Be)، ومغنيسيوم(Mg)، وكالسيوم(Ca)، وسترونشيوم(Sr)، وباريوم(Ba)، والراديوم(Ra)، وتتميّز هذه المجموعة بخواصها المعدنيّة، وقوّة الإرجاع، ودرجة أكسدة مركباتها 2، والانحلال المائيّ الضّعيف لمركّباتها، وقد سميّت بهذا الاسم لأنّ خاماتها توجد على شكل رواسب قليلة الذّوبان في الماء، تتواجد داخل القشرة الأرضيّة. خصائص الفلّزات القلويّة الترابيّة تتّسم مجموعة القلويّات التّرابية ببعض السّمات، وهي: يشغل
التفاعل الكيميائي التفاعل الكيميائيُّ هو عملية تغيير الخصائص الفيزيائية والكيميائية للمواد المتفاعلة، وإنتاج مواد جديدة بخصائص فيزيائيّة وكيميائيّة مُختلفة من خلال تكسير روابط في المواد المُتفاعلة لإنتاج روابط جديدة في المواد الناتجة، وتحدث التفاعلات الكيميائيّة إمّا باتحاد بعض الجزيئات بطرق مُختلفة لتكوين مُركّبات أكبر وأكثر تعقيداً، أو بتفكُّك بعض الجزيئات لتكوين جزيئات أصغر، وأما بإعادة ترتيب الذرات في المركب، وتخضع التفاعلات الكيميائية لقانون حفظ الكتلة؛ الذي ينص على أنّه عند حدوث أيّ
درجة غليان عنصر الزئبق درجة غليان الزئبق هي356.9 درجة مئوية؛ ومن الجدير بالذكر أنه عبارة عن عنصر كيميائي أبيض مائل إلى الفضي، رمزه الكيميائي Hg وهو مشتق من الكلمة اللاتينية "hydrargyrm" أي الفضة السائلة، ويقع في المجموعة الثانية عشرة من الجدول الدوري، وقد عرف في مصر والشرق منذ 1500 عام قبل الميلاد، وبالرغم من اكتشاف سميته في وقت مبكر إلا أنه استخدم بدايةً في الأغراض الطبية، ويعد الزئبق بأنه العنصر الوحيد الذي يكون سائلاً عند درجة حرارة الغرفة. خصائص عنصر الزئبق يتميز الزئبق بالعديد من الخصائص،
التبخّر يُعرّف على أنّه عمليّة فيزيائيّة تتضمّن التحوّل من الحالة السائلة لجزيئات المادّة إلى الحالة الغازيّة، بواسطة الحرارة، ويكون ذلك كلّه على السطح الذي يفصل ما بين المادّة السائلة والغازيّة فقط، لذلك يكون التبخّر على العكس تماماً من التكاثف، كما وتختلف عملية التبخّر عن العمليات الفيزيائية الأخرى كالغليان مثلاً، فعلى سبيل المثال يكون التبخّر على السطح بينما تحدث عملية الغليان داخل الكتلة السائلة نفسها، ويصنّف التبخّر كأحد أهمّ أجزاء دورة المياه الخاصة بالطبيعة. ومن الجدير بالذكر إلى أنّ
المعدن Minerale، هو عبارة عن مركب يمتاز بحالته الصلبة، يتكون في الطبيعة بواسطة عمليات جيولوجية، ويطلق مصطلح المعدن على البنية التي يكون عليها المركب الكيميائي، وتتفاوت خصائص المعادن فيما بينها من حيث التركيب ما بين عناصر نقية وأملاح بسيطة بالإضافة إلى سليكات معقدة، ويطلق على العلم المختص بدراسة المعادن اسم علم العادن. يمكن وصف المعادن بأنها عبارة عن مادة ذات صلابة، تتجانس مكوناتها فيما بينها، وتنفرد بتركيبة كيماوية خاصة بها، وتملك ترتيباً ذرياً عالياً، ويدخل في تركيبها مواد غير عضوية،
عنصر الرصاص يصنّف الرصاص ضمن العَناصر الكيميائيّة الفلزيّة، ويرمز له كيميائيّاً بالرمز Pb، ويمتاز بأنّه من الفلزّات الثقيلة السامّة، يمكن العثور عليه في الطبيعة على هيئة مُركّب كبريتيد الرصاص PbS، وله عدد ذريّ في الجدول الدوريّ هو 82. يُشار إلى أنّ عنصر الرصاص يُستخدم في الصناعات منذ القدم، حيث تمّ العثور على بعض التماثيل المَصنوعة من الرصاص داخل قبور المصريين القدماء، والعثور على آثارٍ تعود أصولها إلى إحدى الحضارات التي قامت في جنوب اليونان، ويُعزى السّبب بكثرة استخدامه إلى سهولة تشكيله
الحديد ferrum، ينضم هذا العنصر الكيميائي لعائلة الفلزات، ويعتبر من أكثر المعادن قدماً من حيث الاكتشاف، ويحتل موقعاً له في الجدول الدوري في المجموعة الثامنة، الدورة الرابعة، ويتخذ من الرقم 26 عدداً ذرياً له، ويرمز له كيميائياً بالرمز Fe. يعتبر من العناصر الهامة في الحياة سواء للإنسان أو الحيوان، فيعتبر أحد مكونات خضاب الدم، كما تعتمد عليه النباتات كعنصر ضروري للتمثيل الغذائي وبالتالي تكوين مادة الكلوروفيل. يعّد عنصر الحديد الرابع من حيث التواجد في القشرة الأرضية، ويمكن العثور عليه في الطبيعة
الألمنيوم يعتبر الألمنيوم من العناصر الكيميائية الفلزية، له لون أبيض مائل للفضي تقريباً، ينتمي لمجموعة البورون من العناصر الكيميائية، ويتخذ من الرقم 13 عدداً ذرياً له، ويرمز له كيميائياً بالرمز Al، ويمكن العثور عليه بالقشرة الأرضية بكثرة إذ يأتي بالمرتبة الثالثة من حيث إمكانية العثور عليه في الكرة الأرضية. يرتبط الألمنيومم مع أكثر من مئتين وسبعين معدناً، ويعود السبب في ذلك إلى أنه معدن حر، كما أنه من المعادن ذات الفعالية الكيميائية العالية، وتبلغ نسبة الألمنيوم في وزن سطح الأرض الصلب نحو 8% من
المركبات العضويّة المركبات العضويّة عبارة عن مركبات كيميائيّة، تحتوي على عنصر الكربون كعنصر أساسي في تركيبها، تتميز بعدم تأينها -عدم ذوبانها في الماء-، وعدم توصيلها للتيار الكهربائيّ، بسبب ارتباطها بروابط تساهميّة، تقلّل من سرعة تفاعلها، كما أنها شديدة الحساسية للتغير الناتج في درجة الحرارة، أو في العامل المساعد، وتتميز بذوبانها في الكحول، والبنزين، والإيثر، وتتشابه بعض المركبات العضويّة في الصيغة الجزيئية لها، إلا أنها تختلف عن بعضها البعض في الصيغة البنائية. درجة الغليان للمركبات العضويّة
درجة انصهار الألومنيوم إنّ درجة الحرارة المطلوبة لانصهار مادّة الألومنيوم هي 660.323 درجة مئويّة، أو 1220.581 فهرنهايت، أو 933.473 كلفن، ويعبّر مفهوم درجة الانصهار عن درجة الحرارة التي تتغيّر فيها حالة المادّة النقيّة الصلبة أو السائلة، فعند تعريض المادّة الصلبة للحرارة سترتفع درجة حرارتها إلى أن تصل إلى درجة تسمّى درجة الانصهار، وعند تعريضها للمزيد من الحرارة ستتحوّل المادّة من الحالة الصلبة إلى الحالة السائلة دون رفع درجة حرارتها، وعند انصهار المادّة الصلبة بشكلٍ كاملٍ سترفع الحرارة
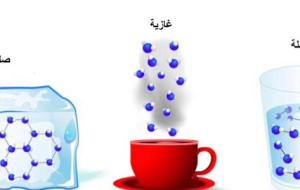
المادة المادة هي كل ما يشغل حيزاً من الفراغ، وله كتلة، وهي مكوّنة من اتحاد مجموعة من أجزاء في غاية الصغر تدعى ذرات، وقد تكون المادة عنصراً أو مركباً أو مزيجاً من العناصر والمركبات، وتتوافر في الطبيعة في الحالات الثلاث، الصلبة أوالسائلة أو الغازية، ونتيجة الضغط والحرارة تستطيع أي حالة من هذه الحالات التحول إلى حالة أخرى، ولمعرفة هذه المواد يجب دراسة خواصها الكيميائية، وهي: سرعة التفاعل، والذائبية، وقابلية الاشتعال والتحليل الكهربائي، كما تتميز المادة بالعديد من الخصائص المتنوعة، كالكتلة والحجم
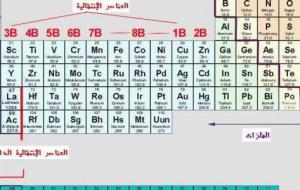
الجدول الدوري الجدول الدوري له عدة مسميّات ومنها جدول مندليف، والجدول الدوري للعناصر، وهو عبارة عن استعراض لكافة العناصر الكيميائية المعروفة في العالم على شكل جدول، ويعود الفضل في إيجاد هذا الجدول إلى الكيميائي ديمتري مندليف عام 1869م، إذ أقدم على وضع العناصر مرتبة في جدول وفقاً لسلوكها الناتج عنها إثر خصائصها الكيميائية. تقسيم الجدول الدوري يُقسّم الجدول إلى مجموعات تتوزّع فيها العناصر البالغ عددها 118 عنصر كيميائي، حيث تصنّف العناصر من 1-98 بأنّها موجودة في الطبيعة، أمّا بقية العناصر من
خصائص غاز النيتروجين يعتبر غاز النيتروجين عنصراً من قائمة اللامعادن ويقع ضمن المجموعة الخامسة عشر على ترتيب الجدول الدوري للعناصر، ويمتاز بأنّه بلا لون ولا رائحة ولا مذاق له ومن أكثر الغازات وفرة ضمن الغلاف الجوي للكرة الأرضية ويعتبر من العناصر الأساسية لبقاء الكائنات الحية، ومن خصائصه الكيميائية نذكر ما يلي: العدد الذري يساوي 7. الوزن الذري يساوي 14.0067. درجة الانصهار تساوي −209.86 سليسيوس. درجة الغليان تساوي −195.8 سليسيوس. الكثافة تساوي 1.2506 غرام/لتر. حالة التأكسد المعتادة (-3، 3، 5).
غاز الفريون غاز الفريون، هو الاسم التجاري لمركبات الكلوروفلوروكربون، (CFC)، وهي عبارة عن مركبات كيميائيّة عضويّة، تحتوي على نسب مختلفة من ذرّات الكلور، والكربون، والفلور في تركيبها، اخترعت في بداية القرن العشرين، كبديل عن الغازات السامّة التي استخدمت في التبريد مسبقاً، مثل غاز الأمونيا. يعتبر (CFC)، و(CFC-12) من أهم هذه المركبات، وتستخدم بشكل أساسي في صناعة البلاستيك الرغوي، وكمادة تبريد في أجهزة التبريد والثلاجات. خصائص غاز الفريون آمن وغير سام، لكنّه مدمّر لطبقة الأوزون في حال إطلاقه. ليس له
عنصر الكلور يعتبر الكلور من العناصر الكيميائية، وعدده الذري 17 ويرمز له بالرمز Cl، وهو ينتمي إلى مجموعة الهالوجينات التي تكون الأملاح، ومن ضمن المجموعة السابعة عشرة في الجدول الدوري، وهو من العناصر المتوفرة بشكل طبيعي في الطبيعة، ويتم استخلاصه من خلال الأكسدة أو من خلال التحليل الكهربائي. تاريخ عنصر الكلور تعني كلمة كلور باللغة الإغريقية الأصفر المخضر، وقد تم اكتشاف الكلور في سنة 1774م من قبل كارل وليهلم شيلي، والذ كان يظن أنّ الكلور يحتوي على الأكسجين، وأطلق عليه اسم (كلور) من قبل همفري دايفي
خصائص عنصر الحديد يمتلك عنصر الحديد العديد من الخصائص الخاصّة به والمحددة لهويّته وهي: يمتلك عدداً ذريّاً يساوي 26، ويعبر عن عدد الإلكترونات التي تحتويها ذرة الحديد الواحدة. يتواجد في الحالة الصّلبة في درجة حرارة الغرفة. يمتلك درجة غليان تساوي تقريباً 3,133 كلفن. يمتلك عنصر الحديد 14 نظيراً. يمتلك كثافةً تساوي 7.87 غراماً لكل سم مكعّب. يمتاز عنصر الحديد بمتانته وسهولة تشكيله. عنصر الحديد ذو لون أبيض لامع. يمتاز الحديد بالهشاشة. يتفاعل بسرعة مع الهواء الرطب مكوّناً طبقة هشة رقيقة تسمى الصدأ .
الجدول الدوري الجدول الدوري يطلق عليه جدول مندليف نسبة إلى العالم الذي قام ببنائه، حيث قام مندليف بترتيب العناصر الكيميائية المعروفة بشكل جدولي، ورتبها حسب خصائصها الكيميائية وحسب تزايد كتلتها، وعبر السنوات تمّ إعادة تخطيط الجدول وإضافة العناصر التي اكتشفت فيما بعد، وقام العالم هنري بإعادة ترتيب العناصر حسب عددها الذري. يحتوي الجدول الدوري في الوقت الحالي على 118 عنصر كيميائي مقسمة إلى عناصر طبيعية موجودة بالطبيعية وتتمثل بالعناصر من1 إلى 98 والعناصر الأخرى والتي تتمثل من 99 إلى 118 عناصر
حالات المادة تحيط بالإنسان الكثير من المواد المختلفة كالماء، والصخور، والهواء وغيرها، وتختلف شكل هذه المواد عن بعضها، ويسمى هذا في علم الفيزياء حالة المادة التي تعني صفة المادة الفيزيائيّة المتعلقة بكيفيّة ارتباط جزيئات المادة مع بعضها، ووجد العلماء أنّ المادة توجد في ثلاث حالات وهي الحالة الصلبة، والسائلة، والغازية، وكلّ من هذه الحالات لها خصائصها التي تتصف بها، فمثلاً تصنّف الصخور تحت حالة المادة الصلبة، أما الماء فحالته سائلة، والهواء حالته غازيّة. خصائص المادة الصلبة يُقصد بالمادة الصلبة