المواد المطلوبة لتحضير نترات الأمونيوم يمكن تحضير نترات الأمونيوم (بالإنجليزيّة: Ammonium Nitrate) من مواد كيميائية بسيطة، وفيما يأتي المكونات الأساسيّة لتحضيرها: 138غم من ثنائي كبريتات الصوديوم، ويمكن العثور عليه ضمن المواد الكيميائية الموجودة في حمامات السباحة؛ حيث يُستخدم لخفض درجة الحموضة. الأمونيا، وتوجد على شكل مادة منظفة في المنزل. الميثانول، -استخدامه اختياري-. مول واحد من أحد أملاح النترات الآتية: 85غم من نترات الصوديوم ، ويمكن العثور عليه في المواد الحافظة الغذائية. 101غم من نترات
تحضير محلول يتمّ تحضير أيّ محلول عن طريق إذابة كتلة معروفة من المذاب التي غالباً ما تكون في الحالة الصلبة في كمية محددة من المذيب، ومن الجدير بالذكر أنّه يتمّ التعبير عن تركيز المحلول باستخدام المولية (Molarity) ويرمز لها بالرمز (M)، والتي تعني عدد مولات المذاب في لتر واحد من المحلول. أمثلة على تحضير المحاليل لتحضير محلول حجمه 1 لتر من محلول كلوريد الصوديوم (NaCl) الذي يبلغ تركيزه 1 M يتمّ اتباع الخطوات الآتية: حساب الكتلة المولية لكلوريد الصوديوم، وتساوي كتلة مول من الصوديوم (Na) مضافاً إليها
الهيدروجين إنّ الهيدروجين هو مادّة غازيّة تعتبر من أبسط المواد في عائلة العناصر الكيميائيّة، ويتميّز بأنّه قابل للاشتعال، وعديم اللون، والطّعم، والرّائحة، ويُرمز له بالحرف H باللغة الإنجليزيّة، أمّا ذرّة الهيدروجين فإنّها تحتوي على إلكترون يرتبط بالنواة ويحمل وحدة واحدة من الشحنات الكهربائيّة السالبة، وبروتون يحمل وحدة واحدة من الشحنات الكهربائيّة الموجبة، ويوجد غاز الهيدروجين على شكل تجمّع حر من جزيئات الهيدروجين المتكوّنة من ذرتين؛ أي (زوج من الذّرات) تحت الظروف الطبيعيّة، ويُرمز لهذا الغاز
طرق تحضير غاز النيتروجين تحضير غاز النيتروجين من الهواء تتمثل إحدى طرق إنتاج النيتروجين من الهواء في أكسدة بعض المواد لتخليص الهواء من الأكسجين الموجود فيه، أي تخليص الهواء من معظم الغازات التي ليست نيتروجيناً، فمثلاً ينتج عن حرق الفسفور أو أكسدة برادة الحديد في وعاء مغلق غاز النيتروجين، بالإضافة إلى كمية قليلة من الغازات الأخرى في الوعاء المغلق، أما الأكسجين فتتم إزالته. هناك طريقة أخرى لإنتاج النيتروجين تتمثل في تمرير الهواء فوق قطعة نحاسية ساخنة في وعاء مغلق؛ حيث يتحد النحاس مع الأكسجين،
الميثان يُرمز للميثان بالرمز الكيميائي CH4، ويتكوّن من أربع جزيئات من الهيدروجين وجزيء من الكربون، وهو مصدر مهم لتوليد الطاقة لأنه أحد المكونات الرئيسية للغاز الطبيعي، ويُستخدم لتشغيل المحرّكات والآلات، ويُستخدم أيضاً لأغراض التسخين مثل الطبخ، وله قُدرة عالية على تسخين الجو إذا تمّ تسريبه مما يؤدي إلى ارتفاع درجات الحرارة بشكل كبير. يتمّ استخراج الميثان من الرواسب الجيولوجية، ويُمكن الحصول عليه أيضاً من قاع المستنقعات والبحار والمحيطات، كما يتم الحصول عليه أيضاً من تحلّل المواد العضوية،
كيفية تكوّن غاز الأوزون يتكوّن جزيء الأوزون (بالإنجليزية: Ozone) من ثلاث ذرّات أكسجين فرمزه الكيميائي (O3)، أيّ أنّه يزيد ذرّة واحدة عن غاز الأكسجين الطبيعي (O2) الذي يتنفسه البشر، ويوجد الأوزون في طبقتين من الغلاف الجوي للأرض، حيث يوجد الأوزون الضار المتكوّن من تفاعل أشعة الشمس مع المواد الكيميائيّة التي تنبعث من المركبات الناتجة من الأنشطة البشرية المختلفة في طبقة التروبوسفير (بالإنجليزية: Troposphere) وهي الطبقة الأقرب إلى الأرض، أمّا الأوزون النافع فيتكوّن طبيعياً في طبقة الستراتوسفير
الحديد يُعدّ الحديد (بالإنجليزيّة: Iron) أحد فلزات عناصر المجموعة الثامنة في الجدول الدوري، والذي يحمل العدد الذري 26، وهو أرخص الفلزات ، وأكثرها استخداماً، والذي يشكّل نسبة 5% من القشرة الأرضية، كما يحتل المركز الثاني بين الفلزات في الوفرة، ويبلغ متوسط كمية الحديد في جسم الإنسان 4.5 جراماً تقريباً يتمثل حوالي 65% منها في صورة هيموجلوبين الدم ، والذي يلعب دوراً كبيراً في جسم الإنسان كنقل جزيئات الأكسجين من الرئتين إلى جميع أجزاء الجسم. يشكّل الحديد العديد من المركبات كالأكاسيد، والتي تكون على
المحلول ويعرف باللغة الإنجليزية بمصطلح (Solution)، وهو مزيج من مادتين أو أكثر من مادة واحدة، ولا يمكن إعادة فصلهما عن بعضهما البعض إلا من خلال استخدام بعض الطرق الكيميائية، ويعرف المحلول أيضاً بأنه خليط بين مادتين: الأولى يطلق عليها اسم (مذيب)، والثانية يطلق عليها اسم (مذاب)، وعادةً تكون نسبة تركيز المادة المذيبة أكبر من المادة المذابة، حتى تختلط المادتان معاً، لتتكون مادةٌ جديدةٌ يطلق عليها مسمى المحلول. حرص علماء الكيمياء على دراسة التفاعلات بين المواد الكيميائية، وتحديد طبيعة العناصر التي
حساب الوزن الذري كيفية حساب الوزن الذري يتم حساب الوزن الذري للعناصر من خلال عدة خطوات، وذلك كالآتي: تحديد الكتل الذرية لجميع النظائر المرتبطة بالعنصر من خلال المعادلة الآتية: (عدد برتونات النظير×كتلة البرتونات (1.0073 و.ك.ذ)) (عدد نيوترونات النظير×كتلة النيوترونات(1.0087 و.ك.ذ)). تحديد الوفرة النسبية لكل نظير، وتكون عادة على شكل نسبة مئوية. ضرب الكتلة الذرية لكل نظير بالوفرة النسبية لهذا النظير (يجب تحويل الوفرة النسبية إلى عدد عشري عن طريق قسمتها على 100). جمع نواتج الضرب وتثبيت الناتج.
اكتشاف الذرة في العصور القديمة يرجح العلماء أنَّ أول ذكر لمفهوم الذرة في التاريخ كان في القرن الخامس قبل الميلاد، عندما قال الفيلسوف اليوناني ليوكيبوس بأنَّ المادة مصنوعة من جسيمات صغيرة، ومع ذلك لم تسد تلك الفكرة في معظم فترات التاريخ اللاحق، حتى ظهور دراسات العالم الإنجليزي روبرت بويل في القرن السابع عشر الميلادي، والتي كانت تتمحور حول المادة والعلاقة بين الحجم والضغط ودرجة الحرارة، كانت وجهة نظره تقول بأنَّ العناصر الكيميائية تمثل المكوِّنات الأساسية لجميع المواد، وميّز بين العناصر
الجدول الدوريّ هو جدول يحتوي على عناصر المركّبات الكيميائيّة للمواد، وتُرتّب فيه وفقاً لمجموعة من المستويات، وسُمّي بالدوريّ للدلالة على تكرار العناصر الكيميائيّة، ويحتوي على 112 عنصراً، وتتوزّع العناصر فيه على مجموعتَي الفلزّات، واللافلزّات، واعتمد توزيعها على نسبة الكتلة الذريّة المكوّنة لكلّ عنصر. كيفيّة تطوّره تطوّر الجدول الدوريّ على عدّة مراحل، منذ اكتشافه، وحتى الوصول إلى الجدول الحديث، والذي يستخدمه العلماء حالياً، والباحثون، والطلاب، وتتوزّع مراحل تطوّره بناءً على الترتيب التالي: جدول
نترات البوتاسيوم نترات البوتاسيوم ورمزها الكيميائي KNO3 هي مركب كيميائي يتكون من ثلاث عناصر وهم البوتاسيوم، والنيتروجين، والأكسجين، وتعتبر نترات البوتاسيوم مادة تساعد على الاشتعال، وذلك لاحتوائها على ثلاث ذرات من الأكسجين، وهي عنصر أساسي في تكوين خام البارود، بالإضافة لاستخدامها كسماد غني بالنيتروجين. توجد هذه المادة في الطبيعة بين مكونات التراب على شكل صخور ملحية عند ما يسمى بالسبخات، ويتم استخلاصها عبر تذويب التراب الغني بهذه المادة في الماء، وبعدها يتم تبريد الراسب الناتج من عملية التذويب
الأحماض القوية تنقسم الأحماض في عِلم الكيمياء إلى أحماضٍ قويةٍ وأحماض ضعيفةٍ، وهي بنوعيّها مركباتٌ كيميائيةٌ لها درجاتٌ متفاوتةٌ من التأين في الماء؛ فالأحماض القوية ( بالإنجليزية:Strong Acid) هي التي تتأين -أي تتفكك في الماء لتعطي أيونات الهيدرونيوم ( بالإنجليزية:H3O- )ويكون تفككها كاملًا في الماء، ويختلف مقدار التأين من حمضٍ قويٍ إلى آخر ويُحدد عن طريق ثابت التأين للحامض ويرمز له بالرمز ( بالإنجليزية: Ka)؛ فلكل حمضٍ ثابت تأين لا يتغير أبدًا ولذلك تمّ جمع هذه الثوابت لكل الأحماض ضِمن جداول
كم عدد عناصر الجدول الدوري يَبلغ عدد العناصر الكيميائية حسب الجدول الدوري (118) عنصراً مرتبةً بشكل تصاعدي حسب العدد الذري (عدد البروتونات) ابتداءاً من غاز الهيدروجين صاحب العدد الذري (1) وانتهاءاً بعنصر أوغانيسون ذو الرقم الذري (118)، وكل عنصر في الجدول الدوري مُدرج بشكل مختصر بحيث يؤخذ الحرف الأول وفي بعض العناصر أول حرفين من اسم العنصر، ومن المؤكد أن الجدول الدوري بوضعه الحالي يعد مكتملاً ولم يتبقى أي خانة خالية ضمن الأدوار السبعة العُلوية، ولكن ربما تظهر ويتم اكتشاف عناصر جديدة، وفي تلك
العنصر الكيميائي يعبّر العنصر الكيميائي عن المادّة الكيميائيّة النقيّة المتكوّنة من نوعٍ واحدٍ من الذّرات، ويتميّز باحتوائه على عددٍ ذريٍ محدد وهو عدد البروتونات داخل نواة الذّرة، ويندرج كل عنصرٍ كيميائي تحت ترتيب الفلز، واللافلز، وأشباه الفلزّات، وتنظّم جميع العنصر في الجدول الدوري الشهير باستخدام الرموز الكيميائية الخاصّة بكلٍ منها. نظرية الانفجار العظيم وتشكّل العناصر نسبةً لنظرية الانفجار العظيم فإنّ أوّل العناصر المتكوّنة هي غازي الهيدروجين والهيليوم، وتجمّعت هذه الغازات معاً لتشكيل
المجهر يُستخدم المجهر لتكبير الأشياء الصغيرة التي لا يمكن رؤيتها بالعين المجردة، ومشاهدتها بوضوح لغايات دراسة تفاصيلها الدقيقة والتعرف إلى أجزائها، وللمجاهر أنواع عدة، أشهرها: المجهر الضوئي بنوعيه البسيط والمركب، وهو الأكثر بساطةً والأشهر، والأكثر استخداماً، والأرخص ثمناً، والمجهر الإلكتروني، والمجهر الأيوني، وللمجاهر أهميةٌ كبرى في علم الأحياء، ودراسة الكائنات الحية، والمواد غير الحية، وللمجاهر استخدامات متعددة في الحياة العملية، ويجب التعامل معها بحذر؛ لأنها أجهزة حسَّاسة وثمينة. استخدامات
القواعد والأحماض تقسم الأوساط الكيمائية من حولنا إلى ثلاثة أقسام وهي الوسط الحمضي، والوسط القاعدي القلوي، والوسط المتعادل، ويستخدم وصف القاعدة والحمض في العديد من المجالات سواءً الكيمائيّة أو الحيويّة، وتتفاوت قوّة الحامض أو القاعدة اعتماداً على درجة تأيّنها في الماء. المصطلحات المرتبطة بقوة الحمض والقاعدة القاعدة: وهي عبارة عن مواد لها القابلية على كسب استقبال أيون الهيدروجين في الماء، مكوّنةً ما يسمّى بمجموعة الهيدروكسيل OH- وتسمّى أيضا بالقلويات. الحمض: وهي مواد تطلق أيون الهيدروجين،
علم الكيمياء يعدّ علم الكيمياء من العلوم الطبيعيّة المعروفة والمستخدمة بين الناس، وهو عبارة عن علم يدرس جزيئات الموادّ والعناصر المختلفة، وتركيبها، وبناءها، وخواصّها، وجميع التغيرات التي تحدث عليها، ويقوم هذا العلم بربط الفيزياء بالعلوم الطبيعيّة، كالجيولوجيا، كما يضمّ العديد من القوانين التي سيتمّ شرح بعضها بالتفصيل في هذا المقال. قوانين في الكيمياء قانون أفوجادرو هو واحد من القوانين المرتبطة بالغازات، وسمّي بهذا الاسم نسبة للعالم الإيطالي أميديو أفوجادرو، الذي وضع نصّه عام 1811، حيث وجد
المختبر المختبر هو أحد المراكز التي تستخدم من أجل تسهيل عمليّة الدراسة واستيعاب المعلومات النظريّة، كما ويساهم في إنتاج العديد من الاختراعات والمواد الجديدة والمختلفة التي تساهم في علاج الكثير من المشاكل البشريّة، وفي تسهيل الكثير من الأمور، وفي هذا المقال سنتعرف على قوانين السلامة في المختبر وبعض الأمور التي يجب معرفتها قبل استخدامه. قوانين السلامة في المختبر قسم الاستقبال الخارجيّ الاهتمام بوجود حاويات للتخلّص من الإبر المستخدمة في السحب، ومن الشرائح الزجاجيّة، والحرص على تغييرها بشكل دوري.
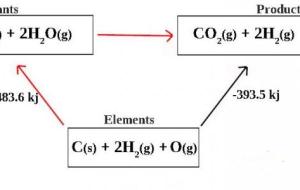
قانون هس في الكيمياء يعبّر قانون هس في الكيمياء عن القانون الذي يصف أنّ التغيّر في الطاقة في التفاعل الكيميائيّ الكليّ يساوي مجموع التغيّر في الطّاقة في كل طرف من أطراف التفاعل الكيميائيّ. اكتشاف قانون هس نُشر قانون هس لمجموع الحرارة من قِبل العالم الكيميائيّ السويديّ جيرمان هنري هس المولود في عام 1840م، حيث نصّ على أنّ الحرارة الممتصّة أو المتحوّلة في أي تفاعلٍ كيميائيٍّ هي قيمة ثابتة ومستقلة في مسار التفاعل الكيميائيّ، أو في المراحل التي أُجريت للحصول على التفاعل، ولكن لا يعتبر قانون هس
الغاز يُعدّ الغاز أحد حالاتِ المادّة الثلاثة: الصلبة والسائلة والغازيّة، وتختلفُ هذه الحالات عن بعضها في الطريقة التي تَملأُ بها الفراغ، وتُغيّر شكلَها؛ فالغاز مثلاً ليس له شكلٌ ثابت، أو حجم ثابت، لكنّه ينتشرُ في الوعاء الذي يحتويه ويأخذ شكلَه، كما أنّ الغازات أقلُّ سُمكاً وأخفّ وزناً من المواد الصلبة والسائلة، ويُمكن تمييزُ الغازات من خلال العديدِ من الخواصّ الكيميائيّة المختلفة كالوزن، والقدرة على الامتصاص، وغيرها. قوانين حجم الغاز قوانين الغازات هي مجموعةٌ من القوانين التي تُفسّر العلاقةَ
النسب المتضاعفة مع التقدّم العلمي الكبير خاصّة في مجال الكشف وتحضير المركّبات الكيميائيّة المختلفة، وجد العلماء أنّ هنالك قوانين تربط بين العناصر التي تكوّن هذه المركّبات الكيميائية، ومن هذه القوانين قانون النسب الثابتة، الذي بيّن أنّ النسبة بين كتل العناصر التي تدخل في تركيب المركّبات الكيميائيّة تبقى ثابتة مهما اختلفت كتلة المركّب الكيميائي، مثل نسبة كتلة الأكسجين إلى كتلة النحاس في مركّب أكسيد النحاس الثنائي تبقى ثابتة وتساوي نسبة واحد إلى أربعة (4:1)، ومن القوانين الأخرى والمهمة في مجال
العناصر الكيميائية مع التقدم العلمي وتطوره في مجال دراسة المركبات الكيميائية والعناصر بشكل عام، ومع تطور الأجهزة المستخدمة في الكشف عن مكونات المركبات الكيميائية ومعرفة العناصر التي تدخل في تركيبها استطاع العلماء ، من خلال هذه الأجهزة والتجارب المختلفة حساب نسبة كل عنصر يدخل في تكوين وتركيب المركب الكيميائي. فمن خلال معرفة نسب هذه العناصر في المركبات الكيميائية نستطيع تصنيع هذه المركبات بكميات مختلفة وحسب الحاجة، دون اللجوء إلى وضع كميات من هذه العناصر بشكل كبير وعشوائي للحصول على كميات قليلة،
الكثافة صفةٌ فيزيائيَّة للأجسام تعبِّر عن العلاقة بين وحدة الحجم ووحدة الكتلة، وتختلف تبعاً لنوع المادة أو الجسم، كما تتناسب الكثافة طردياً مع كتلة المادة، وتتناسب عكسياً مع حجمها، والكثافة تتحكم بطبيعة المادة، فإن كانت الكثافة كبيرةً فإنَّ المادة تكون في الحالة الصّلبة، وإن كانت الكثافة متوسطة؛ فإنَ المادة تكون في الحالة السائلة، وإن كانت الكثافة قليلة أصبحت المادة غازية، باستثناء بعض الحالات، فمن المُمكن أن تكون هناك مادة صلبة وتكون كثافتها أقلّ من السائل وذلك يعود لحجم وكتلة تلك المادة.