تعريف الزئبق يعدّ الزئبق معدناً سائلاً ذا لون فضي لامع، وهو من المعادن الانتقالية، وعدده الذري 80 على الجدول الدوري، ويبلغ وزنه الذري 200.59، ورمزه الكيميائي هو Hg، وهو عنصر سام للغاية من الممكن أن يدخل إلى الجسم عن طريق استنشاقه أو تناوله أو من خلال الجروح، ومن الممكن له أن يسبب تلف الأعصاب، والكبد، والكلى، والعديد من الأعراض الأخرى. من أين يُستخرج الزئبق يزيد عدد المعادن التي تحتوي على الزئبق عن خمسة وعشرين معدناً، لكن المعدن الخام الرئيسي له هو السينابار، وهو عبارة عن معدن لين يتراوح لونه
الجلوتامين الجلوتامين عبارة عن أحد الأحماض الأمينية المهمة في الجسم، وهو لبنة أساسية في بناء البروتين وجزء مهم من الجهاز المناعي، كما أنه له دور فعال في صحة الأمعاء، ويتواجد الجلوتامين في الجسم في شكلين مختلفين هما: "L-glutamine وD-glutamine"، ويقوم الجسم بإنتاج الجلوتامين بشكل طبيعي،، حيث يتم إنتاجه في العضلات ثم توزيعه من الدم إلى الأعضاء التي تحتاج إليه،، ويمكن الحصول عليه من العديد من المصادر الغذائية كالبيض، واللحم البقري، والحليب خال الدسم، والأرز الأبيض، والذرة، كما يتوفر الجلوتامين على
البوتاسيوم يشير الرمز K إلى البوتاسيوم، وهو عنصر كيميائي موجود في المجموعة الأولى، وهي الفلزات القلوية من الجدول الدوري، ويعتبر البوتاسيوم عنصراً مهماً لا غنى عنه لحياة الحيوانات، والنباتات على حدّ سواء، وكان البوتاسيوم أول معدن يتمّ عزله عن طريق التحليل الكهربائي، على يد الكيميائي الإنجليزي السير همفري ديفي، وذلك عندما قام بتحليل هيدروكسيد البوتاسيوم المنصهر (KOH) عام 1807 باستخدام بطارية فولتية. مصادر البوتاسيوم يمكن الحصول على البوتاسيوم عن طريق تناول أصناف معينة من الأطعمة ، ومنها ما يأتي:
المعادن تختلف خصائصها من معدن إلى آخر من حيث كثافتها ووزنها وكميّتها وصلابتها ووزنها ، فالمعادن من أكثر ما تتميّز فيما بينها من حيث الكثافة (الوزن) وهي ما يميّز المعادن فيما بينها . اليورانيوم يعتبر من أكثر المعادن الثقيلة بالنسبة إلى حجمها عندما يكون يورانيوم صافي ، ويعتبر من العناصر المشعّة وله رمز يرمز به وهو حرف U ، ويعرف عدده الذري ب 92 . صفات اليورانيوم من أبرز صفات اليورانيوم أنّه ثقيل جداً بالنسبة إلى حجمه ويبلغ كثافتهُ 20 غرام/سم ولو أخذنا قياس اليورانيوم بنسبة واحد متر مكعب يزن 20 طن
الذرة أصغر مقدار من المادة تعتبر الذرة من أصغر أجزاء المادة، والتي لا يمكن رؤيتها بالعين المجرّدة، وهي وحدة بناء الكون، حيث إنّ جميع العناصر تتكون منها، كما ويصعب تخيلها نظراً لصغر حجمها، فمثلاً قطعة صغيرة من الحديد تتكون من عدة ملايين الذرات، وقد اعتمد علماء الأحياء على رسم صورة تعبيرية عنها نظراً لصعوبة الحصول عليها، وسنعرفكم في هذا المقال على مكوناتها، والعلماء الذين درسوها. مكونات الذرة النواة: تتميز النواة بصغر حجمها، وشحنتها الموجبة، وبثقلها مقارنةً بباقي المكونات. النيوترونات: مكوناتها
الليثيوم من أخف المعادن إنّ من أخفّ المعادن المعروفة في الكون هو معدن الليثيوم؛ حيث يَبلغ عدده الذري 3 فقط؛ إذ تحتوي كل واحدةٍ من ذراته على ثلاثة بروتونات في نواتها. يُعدّ الليثيوم أوّل الفلزّات القلوية في ترتيب الفلزات، وهو يقع في المجموعة الأولى من الجدول الدوري، ولونه فضّي مائل للبياض، وهو ليّن جداً وخفيف إلى درجة بعيدة، وبالتالي يَنصهر على درجات حرارة مُنخفضة جداً، وتنتج العديد من مشتقّاته ومركّباته بكميّاتٍ كبيرة لخدمة أغراضٍ تجارية، وهو من أخفَّ العناصر ذات الحالة الصلبة في الجدول الدوري
معنى الكيمياء تعرف الكيمياء (بالإنجليزية: Chemistry) بأنها العلم الذي يدرس خصائص المواد، وتركيبها، وهيكلها، والتحولات التي تمر بها، والطاقة التي تنتجها أو تمتصها خلال هذه العمليات، وتتكون المواد الطبيعية والمصنعة على حدٍ سواء من نوع واحد أو أكثر من أنواع الذرات الفردية المعرّفة كعناصر، وعلى الرغم من كون هذه الذرات تتكون من جزيئات أولية إلا أنها تعتبر لبنة أساسية للمواد الكيميائية، وقد شهد القرن العشرين تقدماً ملحوظاً في فهم كيمياء الكائنات الحية والتفسيرات العلمية التي تتعلق بالصحة والمرض.
تعريف النظير يُعرف النظير على أنه واحد من نوعين أو أكثر من ذرات عنصر كيميائي لهما نفس العدد الذري ونفس الموقع في الجدول الدوري للعناصر، ويتشاركان في الخصائص الكيميائية تقريباً مع اختلاف الكتل الذرية والخصائص الفيزيائية، ويوجد لكل عنصر كيميائي واحد أو أكثر من النظائر. طريقة كتابة النظير هناك طريقتان شائعتان للإشارة إلى النظير وترميزه، وهما كما يلي: كتابة العدد الكتلي للعنصر بعد اسمه أو رمزه؛ فمثلاً النظير الذي يمتلك 6 بروتونات، و6 نيوترونات هو كربون -12 أو (C-12)، مع ملاحظة أنه يُمكن أن يتواجد
درجة الحرارة وكميّة الحرارة يظنّ الإنسان العادي أنّ الحرارة ودرجة الحرارة مصطلحين مختلفين لذات المعنى، أمّا الشخص العامل في مجال الفيزياء فإنّه يدرك تماماً أنّ هناك العديد من الفروق بينهما؛ فوحدة القياس تختلف فيهما، كما تستخدم إحداها للإشارة عن الطاقة الداخلية، بينما تُشير الثانية للطاقة الحركية كما هو موضّح في هذا المقال. الفرق بين درجة الحرارة وكميّة الحرارة يُعدّ تعريف النظرية الذرية لحركة جزيئات المادّة ذا أهميّة كبيرة في التفريق بين مفهومي درجة الحرارة وكميّة الحرارة، فهي تُوضّح مفهوم
المعادن الثقيلة يشير مصطلح المعادن الثقيلة إلى أي عنصر كيميائي معدني يحتوي على كثافة عالية نسبياً وغير سامة أو سامة في تركيزات منخفضة ، أمثلة من المعادن الثقيلة تشمل الزئبق (زئبق)، الكادميوم (الكادميوم)، الزرنيخ (As) والكروم (الكروم)، الثاليوم (TL)، والرصاص (الرصاص). المعادن الثقيلة هي المكونات الطبيعية من القشرة الأرضية ، لا يمكن أن تتدهور أو تدمر.، ونحن نستهلك حد صغير عبر دخولهم إلى أجسامنا عن طريق الغذاء ومياه الشرب والهواء ، كما العناصر النادرة ، وبعض المعادن الثقيلة (مثل النحاس
توفير مِهن متنوّعة تفتح دراسة الكيمياء المجال أمام الأشخاص الّذين يَمتلكون المهارة فيها لتولّي مَناصب في مجموعةٍ مُتنوّعة من المهن المفيدة والمثيرة للاهتمام، والمُجزية في مجالات الصناعة، والخدمات العامة، والتعليم، كما تُعتبر شهادة الكيمياء بمثابة أساس ممتاز للدراسة المتقدّمة في عددٍ من المجالات ذات الصلة؛ فحتى في الأوقات التي تكون فيها مُعدّلات البطالة مرتفعة يكون الكيميائي أحد أكثر الباحثين المَطلوبين للوظائف المختلفة، وذلك لأنّ دراسة الكيمياء التي تعرف بِـ " العلم المركزي" تُوفّر معارف في
علم مركزي يُشار إلى علم الكيمياء عادة أنه علم مركزي؛ لأنه يربط الرياضيات والفيزياء معاً، كما يربط الأحياء بالطب، وعلوم الأرض بالبيئة؛ لذلك تؤدي معرفة طبيعة المواد الكيميائية، والعمليات الكيميائية إلى منح رؤى ثاقبة للعديد من الظواهر الفيزيائية والبيولوجية المختلفة، كما أن معرفة القليل عن الكيمياء يعد أمراً مفيداً لبناء قاعدة لفهم الكون من حول الإنسان. يتيح الحصول على درجة البكالوريوس في الكيمياء الفرصة للحصول على وظائف في الصناعة، والتعليم، والخدمات العامة، كما يتمكن الكيميائي الذي يفهم الظواهر
شحنة النواة تحتوي الذّرة على نواة موجبة الشحنة، تحاط بواحد أو أكثر من الإلكترونات سالبة الشحنة، وتحتوي النواة على نوعين من الجسيمات، وهي الشّحنات الموجبة وتسمّى بروتونات، والنيوترونات التّي لا تمتلك شحنة، لذلك تمتلك النواة شحنة موجبة دائماً، كما أنها تعد صغيرة جداً مقارنة بحجم الذرة، وتعادل الشحنات الموجبة للبروتون الشحنات السالبة في الذرة؛ لذلك تكون الذرات متعادلة كهربائياً، وعند ارتباط إحدى الذرات بذرة أخرى فإن ذلك يتم عن طريق الإلكترونات التي يحدّد عددها البروتونات الموجبة في داخل النّواة
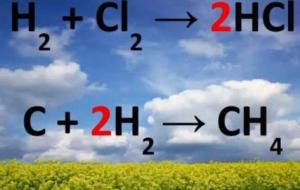
خطوات وزن المعادلة الكيميائية تتم عملية وزن المعادلة الكيميائية في عدة خطوات متسلسلة، كما يلي: كتابة المعادلة الكيميائية المراد وزنها، مثل عملية حرق البروبان، حيث يتم التفاعل في وجود الأكسجين وينتج الماء، وثاني أكسيد الكربون كما هو موضح: C3H8 O2 ---> H2O CO2 كتابة عدد الذرات لكل عنصر في كلا جانبي المعادلة، وذلك بالنظر إلى الأجزاء المجاورة لكل ذرة لإيجاد عدد الذرات في المعادلة. عدد الذرات في الجانب الأيسر: عدد ذرات الكربون= 3، وعدد ذرات الهيدروجين= 8، وعدد ذرات الأكسجين= 2. عدد الذرات في الجانب
كيفية موازنة معادلة كيميائية تمر عملية موازنة المعادلة الكيميائية في عدة خطوات نوجزها بالآتي: كتابة معادلة كيميائية غير موزونة يتعين على الطالب حينما يعمل على موازنة المعادلة الكيميائية الغير موزونة والمشتملة على مواد متفاعلة ومواد ناتجة عن التفاعل أن يُطبق قواعد تسمية المركبات لتحديد الصيغ الكيميائية لها، مثل معادلة تشكل صدأ الحديد التي تتضمن الحديد والأوكسجين كمواد متفاعلة والصدأ هو الناتج عن ذاك التفاعل والذي يمكن كتابة معادلته الغير موزونة كالآتي (Fe O2 → Fe2O3) حيث Fe رمز الحديد والـ O2
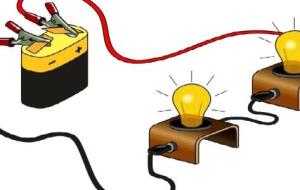
مفهوم الدائرة الكهربائية يُمكن تعريف الدائرة الكهربائية على أنها حلقة مُغلقة تسري فيها الإلكترونات ، وفي الغالب تكون البطارية هي مصدر هذه الإلكترونات أو مصدر للتيار الكهربائي الذي يَسري في الدائرة، ولن تسري بها الإلكترونات في حالة عدم إغلاق الدائرة بشكل كامل، ويتم الاستفادة من الدوائر الكهربائية بشكل عام للقيام بعمليات توليد الكهرباء، أو الحرارة ، أو الطاقة الميكانيكية. إذا كانت الدائرة الكهربائية من النوع البسيط فإنها تكون عبارة عن حلقة مُغلقة تَجمع ما بين بطارية واحدة أو أكثر، بالإضافة إلى
كيفية حساب كمية المادة يمكنُ حسابُ الصيغة النسبية لكمية المادّة ضمن مُركّب معيّن، من خلال جمع كلٍّ من الكتل الذرية النسبية مع بعضها للذرات المشتركة في تركيب الصيغة الكيميائية، والجدير بالذكر هنا أنّ المول يمثّل عددَ الوحدات المستخدمة لقياس كميات المواد، والمعادلة التالية تبيّن معادلة كمية المواد النسبية، حيث يرتبط كلٌّ من عدد المولات، والكتلة في تلك المعادلة: (عدد المولات = الكتلة ÷ الكتلة النسبية)، ويمكن إعادة صياغة تلك المعادلة، وترتيبها في حال كان عدد المولات، والكتلة المولية معروفين (بوحدة
نظرة عامة حول الكتلة الحجمية يُطلق على الكثافة (بالإنجليزية: Density) مصطلح الكتلة الحجمية، وهي كمية قياسية فيزيائية تُعبّر عن مقدار ما يحتويه الجسم من مادة في حجم معيّن، أيّ أنّها تُعبّر عن مدى تراص جزيئات المادة معاً، وكان العالم اليوناني أرخميدس أول من اكتشف نظرية الكثافة والكتلة والحجم، ويُرمز للكتلة الحجمية بالحرف اليوناني (ρ) أو بالحرف الإنجليزي (D)، وبعبارة أخرى يُمكن تعريف الكتلة الحجمية بأنّها عدد الكيلوغرامات التي يحتويها متر مكعب واحد من المادة. كيفية حساب الكتلة الحجمية يتمّ حساب
كيفية تكون الماء يتكوّن الماء نتيجة اندماج غازيّ الهيدرجين والأكسجين مع بعضهما خلال تفاعلٍ كيميائيّ، ويحدث ذلك بانفصال جزيء من الهيدروجين H2 عن بعضه؛ لتندمج كل ذرة من الهيدروجين بأحد أطراف ذرة الأكسجين كبيرة، فيتكون جزيء الماء H2O، وتبيّن المعادلة الكيميائية التالية معادلة تفاعل الماء النقيّ حيث يحتوي على العدد نفسه من ذرات الأكسجين والهيدروجين قبل التفاعل دون أيّ زيادة أو نقصان أو انقسام في عدد الذرات المتفاعلة بنسبة 2:1 ، وهذا ما يتّفق مع مبدأ دالتون الرابع، حيث يعتقد العالم دالتون أنّ ذرّات
تسمية المركبات الكيميائية لتسمية المركبات الكيميائية يجب مراعاة الأمور الآتية: تقسم المركبات الكيميائية إلى نوعين أساسيين هما المركبات الأيونية التي تنشأ بين العناصر الفلزية، والعناصر اللافلزية، والمركبات التساهمية التي تنشأ بين اللافلزات فقط. تتكون المركبات الأيونية عندما يفقد الفلز إلكتروناته، ويعطيها للعنصر اللافلزي. يُمكن تقسيم المركبات الأيونية إلى مركبات أيونية لا تحتوي على عناصر انتقالية، ومركبات تحتوي على عناصر انتقالية. تسمية المركبات الأيونية الثنائية تتكون المركبات الأيونية من
تسمية المركبات العضوية حسب نظام الأيوباك يُعرف الأيوباك (IUPAC) بأنه الاتحاد الدولي للكيمياء البحتة والتطبيقية، وهي منظمة عالمية دولية غير تابعة لأي حكومة، تسعى إلى تطوير الكيمياء عن طريق وضع معايير عالمية للأسماء، والرموز، والوحدات، ومن الجدير بالذكر أنه يشارك ما يقارب 1200 كيميائيّ في مشاريع الأيوباك، وتشرف ثمان لجان على عملهم في مجال الكيمياء. تتمّ تسمية المركبات العضوية بنظام الأيوباك حسب مجموعتها الوظيفيّة، كما في الجدول الآتي: المجموعة الوظيفية اللاحقة التي تضاف في نهاية المركب عند
تسمية الأمين الأولي يتمّ تسمية الأمين الأولي عن طريق إضافة كلمة أمين إلى نهاية اسم المجموعة الكربونية ، وذلك كما هو موضح بالمثال الآتي: CH3CH2CH2CH2CH2CH2NH2 بما أنّ عدد الكربونات هو 6 فإنّ اسم الألكان هكسان، ويتمّ إضافة كلمة أمين، وبالتالي فإنّ اسم المركب حسب الاتحاد الدولي للكيمياء البحتة والتطبيقية (IUPAC) هو: 1-هكسان أمين، ويشير الرقم 1 إلى رقم الذرة التي تتصل بها مجموعة الأمين. لتسمية المجموعات الكربونية يتمّ الاستعانة بالجدول الآتي: عدد ذرات الكربون الاسم 1 ميثان 2 إيثان 3 بروبان 4
قواعد نظام الأيوباك IUPAC في تسمية الألكانات وهذه القواعد هي: تسمية أطول سلسلة كربونية . تسمية التفرعات التي توجد على هذه السلسلة. ترقيم السلسلة بشكل متتابع، وإعطاء الذرة القريبة من التفرع الرقم الأصغر. ترقيم التفرعات، وترتيبها حسب الحروف الأبجدية. في حال وجود أكثر من تفرع يتم استخدام المصطلحات ثنائي (di)، وثلاثي (tri)، ورباعي (tetra) للتعبير عنهم. ملاحظة: في حال احتواء السلسلة على عنصر من عناصر الهالوجينات يتم إضافة اسم العنصر إلى السلسلة، فمثلاً في حال وجود عنصر الفلور يضاف الاسم فلورو
طرق تحلية مياه البحر التحلية بالطرق الحرارية تتضمن هذه العملية تسخين المياه حتى تتبخر، ثم تكثيف البخار الناتج للحصول على الماء النقي، وتتضمن ثلاث مراحل؛ وهي التقطير بالبخار (بالإنجليزية: vapor distillation)، والتقطير مُتعدد المراحل (بالإنجليزية: multistage distillation)، والتقطير متعدد التأثير (بالإنجليزية: multiple-effect distillation)، ومن الجدير بالذكر أن هذه العملية تحتاج إلى كمية كبيرة من الطاقة لتسخين المياه. التحلية بالطرق الكهربائية يتم في هذه الطريقة استخدام التيار الكهربائي لفصل