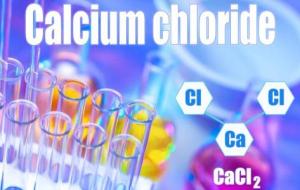
تعريف كلوريد الكالسيوم يُمكن تعريف كلوريد الكالسيوم (بالإنجليزية: Calcium chloride) بأنّه مادة ذات بلّورات بيضاء، قابلة للذوبان في الماء، ويحمل الصيغة الكيميائية CaCl2، وهو مُركّب غير عضوي، ويُطلق عليه اسم كلوريد الكالسيوم اللامائي أو ثُنائي كلوريد الكالسيوم، وهو يتكون من أيونات الكلور والكالسيوم، وله طاقة كامنة عالية (بالإنجليزية: enthalpy)، كما يُعد جاذباً قوياً للماء (بالإنجليزية: hygroscopic). خصائص كلوريد الكالسيوم فيما يأتي أبرز الخصائص المُتعلقة بكلوريد الكالسيوم: الكتلة المولية: 110.98
كلوريد الصوديوم كلوريد الصوديوم هو الاسم الكيميائيّ للملح ، والذي يُنظّم كميّة المياه في الجسم، ويلعب دوراً مهماً في التحكم بنبضات العصب وتقلّصات العضلات. يُمكن استخدام كلوريد الصوديوم لعلاج أو منع فقدان الصوديوم الناجم عن الجفاف، والتعرّق المفرط، وله العديد من الأغراض الأخرى. يعدّ كلوريد الصوديوم عبارة عن مركّب أيوني، يتكون من عدد متساوٍ من ذرات الصوديوم موجبة الشحنة، وأيونات الكلوريد سالبة الشحنة، وعندما يذوب هذا المركب في الماء فإنّ الأيونات تتحرك بحريّة، ويصبح كلوريد الصوديوم المذاب موصلاً
تعريف كلوريد البوتاسيوم يُعرف مركب كلوريد البوتاسيوم (بالإنجليزية: Potassium Chloride) بأنه هاليد معدني يتألف من البوتاسيوم والكلور، ويظهر شكله على هيئة بلورات بيضاء عديمة اللون، وله طعم ملحي قوي، كما يذوب كلوريد البوتاسيوم بسهولة في الماء، ويكون نوع الرابطة الكيميائية التي تجمع ذرات البوتاسيوم والكلور في جزيء كلوريد البوتاسيوم هو رابطة أيونية . خصائص كلوريد البوتاسيوم الخصائص الفيزيائية من أهم الخصائص الفيزيائية لمركب كلوريد البوتاسيوم ما يأتي: تتكون بلورات كلوريد البوتاسيوم من نظام بلوري
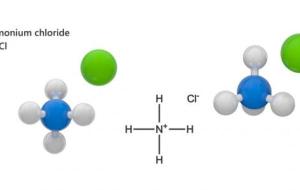
كلوريد الأمونيوم كلوريد الأمونيوم هو عبارة عن مركب كيميائي يمتلك الصيغة الجزيئية (NH4Cl) أو (ClH4N)، ويكون على شكل بلورات صلبة بيضاء اللون عديمة الرائحة ولها طعم مالح لاذع وقابلة للذوبان في الماء بنسبة 37%، وتبلغ درجة انصهاره حوالي 350 درجة مئوية وتقدَّر كثافته ب 1.5 غ/سم، ويعتبر كلوريد الأمونيوم مركباً مستقراً نوعاً ما في ظل ظروف التخزين الصحيحة ولكن يمكن أن يتبخر ويتكاثف على الأسطح الباردة عند درجات الحرارة المنخفضة. استخدامات كلوريد الأمونيوم يستخدم كلوريد الأمونيوم في العديد من المجالات،
كربونات الكالسيوم تُعرف كربونات الكالسيوم بأنها مركب كيميائي يحمل الصيغة الكيميائية CaCO3، ويتكون من ثلاثة عناصر هي الكربون، والأكسجين، والكالسيوم، وهي مادة شائعة موجودة في الصخور في جميع أنحاء العالم، وأشهرها الحجر الجيري ، وهي المكون الرئيس لأصداف الكائنات البحرية، والحلزون، ودرنات الفحم (بالإنجليزية: coal balls)، واللؤلؤ، وقشر البيض، ومن الجدير بالذكر أن هذا المركب له أشكال بلورية مختلفة تِبعاً لمجموعة من المتغيرات. الخصائص الفيزيائية لكربونات الكالسيوم تكون كربونات الكالسيوم على شكل مسحوق
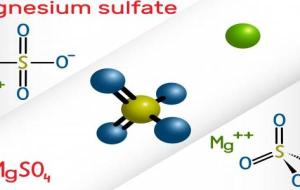
كبريتات المغنيسيوم كبريتات المغنيسيوم هو مركب كيميائي يحتوي على عنصر المغنيسيوم والكبريت والأكسجين بصيغته الجزيئية MgSO4، ويساوي وزنه الجزيئي 120.316 غم/مول، ويُطلق عليه اسم الملح الإنجليزي (بالإنجليزية: Epsom salt)، كما أنه يوجد في الغالب على شكل هيبتاهيدرات (بالإنجليزية: Heptahydrate) ذات الصيغة الجزيئية MgSO4·7H2O، بحيث يحاط المركب بسبعة جزيئات من الماء، وقد يكون على شكل أحادي الهيدرات (بالإنجليزية:Monohydrate) ذي الصيغة الكيميائية MgSO4·H2O التي تستخدم عادة في مجال الزراعة. خصائص كبريتات
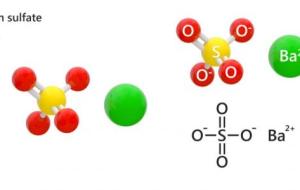
كبريتات الباريوم يُعدّ مركب كبريتات الباريوم ذو الصيغة الجزيئية BaSO4 والشحنة -2 أحد أشهر المركبات غير القابلة للذوبان في الماء، وهو مركب مستقرّ وخامل غير قابل للاشتعال، ولونه أبيض مائل إلى الاصفرار قليلاً، وتصل درجة انصهاره إلى 1,580 درجة مئوية، أمّا عن كثافته النوعية فهي مرتفعة و تصل إلى ما بين 4.25 و 4.50. استخدامات كبريتات الباريوم يُشاع استخدامه في الطب الإشعاعي؛ بسبب ذراته الكبيرة والثقيلة التي تمكنه من الامتصاص الجيد لأشعة إكس وتصنيفه ضمن المواد غير المنفذة للإشعاع، فمن خلاله يتم تشخيص
قانون عدد المولات يمكن تعريف المول بأنه كمية من المادة تساوي عدد الجُسيمات الموجودة في 12 غم من ذرة الكربون-12، وهذا يساوي عدد أفوجادرو من الذرات (Avogadro's number)، ويساوي 6.022x10، ومن الجدير بالذكر أن عدد أفوجادرو يمكن تطبيقه على أية مادة سواء كانت ذرات، أو أيونات، أو جزيئات، أو أي شيء آخر، وهذا يساعد الكيميائيين على التعامل مع عدد كبير من المواد. يحتوي المول واحد من أي مركب على 6.022x10 من الجزيئات، وكتلة المول واحد من هذا الجزيء تُعرف بالكتلة المولية (molar mass)، وتقاس بوحدة غرام/مول،
قانون حفظ الكتلة يرجع قانون حفظ الكتلة إلى عام 1789م، حيث لاحظ العالم لافوازييه (Antoine Lavoisier's) أن الكتلة لا تنشأ ولا تفنى خلال التفاعلات الكيميائية، وأن كتلة المادة عند بداية التفاعل تكون نفس كتلتها عند نهاية التفاعل، وهذا يعني أن كتل المواد المتفاعلة تساوي كتل المواد الناتجة في أي نظام مغلق، وقد ساعد اكتشاف لافوازييه على العديد من الاكتشافات في علم الكيمياء، كما يعد قانون حفظ الكتلة صحيحاً، وذلك لأن جميع العناصر التي توجد على سطح الأرض لا تتحول إلى عناصر أخرى خلال التفاعلات الكيميائية،
فوسفات الكالسيوم يُعد فوسفات الكالسيوم (بالإنجليزيّة: calcium phosphate) أحد مركبات الكالسيوم الموجودة في الطّبيعة بكميات كبيرة، ولها أشكال متعددة يستخدم بعضها لإنتاج مركبات الفوسفات، ولصناعة الأسمدة الفوسفاتيّة، وتتميّز جميع مركبات فوسفات الكالسيوم بأنّها عديمة الطّعم والرّائحة، وتوجد على شكل بلورات بيضاء أو عديمة اللون، أو على شكل مَسحوق، ويشمل اسم فوسفات الكالسيوم عدة مركبات؛ مثل: فوسفات أُحادي الكالسيوم، وفوسفات ثُنائي الكالسيوم، وفوسفات ثُلاثي الكالسيوم. فوسفات أُحادي الكالسيوم يُعرف
تعريف فوسفات الصوديوم يُمكن تعريف فوسفات الصوديوم (صيغته الكيميائية: Na3PO4) بأنّه مسحوق ذو لونٍ أبيض، عديم الرائحة، ليس له طعم، يكون على شكل بلّورات أو حُبيبات، وهو قابل للذوبان بسهولة في الماء، ولكنه غير قابل للذوبان في الإيثانول، كما أنه يتفكك عند تسخينه، وتنبعث منه أبخرة وغازات سامة مثل أكسيد الفوسفور (بالإنجليزية: phosphoxides)، وأكسيد الصوديوم (بالإنجليزية: sodium oxide). خصائص فوسفات الصوديوم الخصائص الفيزيائية فيما يأتي أهم الخصائص الفيزيائية المُرتبطة بفوسفات الصوديوم (بالإنجليزية:
ما هو غاز الهيليوم؟ يُعتبر غاز الهيليوم (بالإنجليزية: Helium Gas) عنصراً كيميائياً أُحادي الذرّة، عديم اللون والرائحة والطعم، وتساوي كتلته الذرية 4.003 وحدة كتلة ذرية، وهو من عناصر مجموعة الغازات النبيلة وهي المجموعة 18 في الجدول الدوري، بالإضافة إلى أنّه ثاني أخف عنصر كيميائي بعد الهيدروجين، ويحتل أيضاً المرتبة الثانية من ناحية أكثر العناصر وفرةً في الكون بعد عنصر الهيدروجين، أمّا عن مكان تواجده فيُعتبر الغاز الطبيعي المصدر الرئيسي لغاز الهيليوم؛ إذ يحتوي على ما نسبته 0.4% من الهيليوم. خصائص
تعريف غاز الهيدروجين يُعدّ الهيدروجين (بالإنجليزية: Hydrogen) أول عنصر في الجدول الدوري، ورمزه الكيميائي (H)، وعدده الذري 1، كما أنّه موجود بشكل طبيعي كغاز ثنائي الذرة معادلته الجزيئية (H2)، وله خصائص عدّة، منها: أنّه عديم اللون، وعديم الرائحة، وعديم الطعم، بالإضافة إلى أنّه قابل للاشتعال بسهولة، وتتكوّن له نار زرقاء باهتة، كما أنّه أخف وزناً من الهواء، ولا يعدّ الهيدروجين ساماً لكنه يسبب الاختناق لأنه يمنع وصول الأكسجين. استخدامات غاز الهيدروجين يُستخدم غاز الهيدروجين في عدّة صناعات من أهمّها
غاز الهالون يُعرف غاز البرومو-ثلاثي فلورو- ميثان (بالانجليزية: BROMOTRIFLUOROMETHANE) والمعروف باسم غاز الهالون (بالانجليزية: Halon Gas) بأنّه غاز عديم اللون، وعديم الرائحة، صيغته الجزيئية هي (CBrF3)، وهو غاز غير سامّ ولكن يمكن أن يسبب الاختناق لأنه يزيح الهواء ويحل محله، كما أن ملامسة الغاز السائل لجلد الإنسان يسبب قضمة الصقيع (بالانجليزية: frostbite)، بالإضافة إلى أنّ تعرّض الحاوية التي تحفظ الغاز للحرارة لفترة طويلة قد يتسبب في تمزقها وانفجارها بعنف. خصائص غاز الهالون الخصائص الفيزيائية من
تعريف بغاز النيون يُعرف غاز النيون بأنه غاز نبيل، ويقع عنصر النيون في المجموعة الثامنة عشر، وهي مجموعة الغازات النبيلة من الجدول الدوري، لذا فهو غاز خامل كيميائياً، وعديم اللون، والرائحة، والطعم، كما أنّه أخف وزناً من الهواء، وقد تم اكتشاف النيون للمرة الأولى عام 1898م من قِبل العالمين الكيميائيين البريطانيين وليام رامزي وموريس ترافرز، وقد تمّ التعرّف عليه مباشرة نتيجة لانبعاث وهج فريد من نوعه نتيجة لتحفيزه كهربائياً، ويُعتبر الغلاف الجوي هو المصدر الرئيسي والوحيد لعنصر النيون، ومن الجدير
غاز الميثان يعتبر غاز الميثان (بالإنجليزية: Methane) العنصر الرئيسيّ للغاز الطبيعيّ حيث يحتوي على 50-90% من الميثان، والوقود الأحفوري أيضاً، والميثان غاز غير مرئيّ، عديم الرائحة، قابل للاحتراق، يتواجد بكميات ضئيلة في الغلاف الجوي . يتكوّن الجزيء من ذرة كربون واحدة مرتبطة بأربع ذرات من الهيدروجين (CH4)، الأمر الذي يجعل الميثان أبسط عضو في عائلة كيميائية تُعرَف باسم الهيدروكربونات، وتشمل كلاً من: الإيثان (C2H6)، والبروبان (C3H8)، والبوتان (C4H10). مصادر غاز الميثان يعدّ الميثان كعنصر من الغازات
ما هو غاز الكيمتريل يعتبر غاز الكيمتريل نوعاً من أنواع الغازات السامة، والتي تعد نوعاً حديثاً من أسلحة الدمار الشامل، وهو مجموعة من المركبات الكيميائية التي يمكن نشرها على ارتفاعات جوية محددة، بغية استحداث ظواهر طبيعية وإحداث أضرار بشعة بشكل اصطناعي، كاصطناع العواصف والزلازل والأعاصير والبرق والرعد، بالإضافة إلى إمكانية إصطناع ظواهر التصحر والجفاف ووقت هطول الأمطار، وخلق كل ظاهرة تستوجب استخدام نوع محدد من الكيماويات يختلف عن غيره. معلومات عن غاز الكيمتريل الاستمطار واستحداث الظواهر الطبيعية
غاز الفريون غاز الفريون هو الاسم التجاري لفئةٍ معينة من المواد الكيميائية العضوية التي يطلق عليها مركبات الكلوروفلوروكربون (بالإنجليزية: Chlorofluorocarbon - CFC)، ومركبات الهيدروكلور فلوروكربون (بالإنجليزية: Chydrochlorofluorocarbon - HCF)، وبعض المركبات المشابهة. ويحتوي غاز الفريون في الغالب على عنصر الهيدروجين ، وعنصر البروم، وعنصر الكلور ، بالإضافة إلى عنصري الفلور والكربون . صفات غاز الفريون يعد غاز الفريون من الغازات غير القابلة للاشتعال، والتي تتميز بأنها عديمة اللون، وعلى الرغم من أن
غاز الطبخ غاز الطبخ أو ما يُطلق عليه اسم الغاز البترولي المسال، (بالإنجليزية: Liquefied Petroleum Gas)، أو ما يسمى بالغاز النفطيّ المسيل، هو عبارة عن خليط من الغازات التي تخزّن تحت ضغط عالٍ، للحفاظ على حالتها السائلة، ويتم تخزينه بأسطوانات، أو خزانات، مصنوعة من الفولاذ الثقيل، أمّا درجة غليانه فتتراوح من -44 درجة مئوية، إلى 0 درجة مئوية، وقد تمّ استخدامه عام 1860م كمصدر للوقود المتنقل، ومن ثمّ انتشر إنتاجه واستهلاكه للاستخدام المنزليّ والصناعيّ، وعادةً ما يتكوّن غاز الطبخ من الإيثان
غاز الضحك غاز الضحك هو غاز أكسيد النيتروز (بالإنجليزية: Nitrous oxide)، ويسمى أيضاً بأول أكسيد النيتروجين (بالإنجليزية: Dinitrogen Monoxide)، وهو أحد أكاسيد النيتروجين العديدة، كما أنّه عديم اللون ، وله رائحة لطيفة، ومذاق حلو، ويسبب استنشاقه عدم الشعور بالألم مسبوقاً بحالة هستيريا خفيفة تترافق مع حالة من الضحك في بعض الأحيان، بالإضافة إلى أنّ استنشاق كميات صغيرة منه يسبب تأثيراً قصيراً من البهجة، حيث استخدم كعقار ترويحيّ أدى إلى الإدمان في بعض الأحيان. استخدامات غاز الضحك يستخدم أكسيد النيتروز
ما هو غاز الرادون الرادون هو عنصر كيميائيّ يحمل الرمز Rn، وقيمة العدد الذريّ له في الجدول الدوريّ هي 86، وهو غازٌ عديم اللون والطعم والرائحة، ويعدّ الرادون خامس عنصر كيميائيٍّ مشعّ، اكتشفاه إرسنت رذرفورد وروبرت بي أوينز في عام 1899م، واسمه مشتق من اسم العنصر الكيميائيّ الراديوم، وكان اسمه في بداية الأمر رادون نيتون، وهو اسم مشتقّ من الكلمة اللاتينية nitens وتعني اللامع. يعتبر الرادون عنصراً خاملاً كيميائياً، وغير قابلٍ للاشتعال، وهو سام جداً، حيث يعدّ ثاني أكثر المسببات لسرطان الرئة بعد
غاز البروبان الصيغة الكيميائية للبروبان هي C3H8، أي أنّه يندرج تحت المركبات الهيدروكربونية، وهو العضو الثالث من سلسلة البارافين التي يتصدّرها الميثان، ثمّ الإيثان، ويتم الحصول عليه من خلال فصل الغاز الطبيعي، أو النفط الخام الخفيف، كما أنّه متاح تجارياً بشكل واسع، وهو مادة مهمة في صناعة الإيثيلين للبتروكيماويات، والبروبيلين المستخدم في صناعة الأسيتون، ويمكن استخدامه كوقود للاستخدامات المنزلية، ومحركات الاحتراق الداخليّ. تاريخ البروبان تاريخ البروبان ليس بالتاريخ الطويل، حيث تمّ اكتشافه في عام
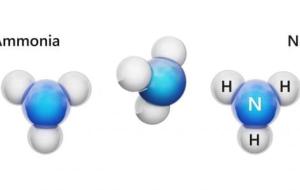
تعريف غاز الأمونيا يمكن تعريف غاز الأمونيا أو النشادر (بالإنجليزية: Ammonia) بأنه غاز قلويّ عديم اللون، وينتجه الجسم أثناء تحليل المواد العضوية خلال عمليات الأيض المهمة، ويُطلق على الشكل المائي للأمونيا اسم هيدروكسيد الأمونيوم (بالإنجليزية: Ammonium Hydroxide)، ويعد غاز الأمونيا مركباً غير عضوي يتكوّن من النيتروجين والهيدروجين، وصيغته الجزيئية (NH3)، وله رائحة نفاذة ومميزة، ومن الجدير بالذكر أنّه عند تعرّض الإنسان لغاز الأمونيا يحصل له تهيّج للجلد، والعينين، والأنف، والحنجرة، والرئتين. خصائص
غاز الأسيتيلين يُعرف غاز الأسيتيلين باسم الإيثاين (بالإنجليزية: Ethyne)، وهو أبسط سلسلة هيدروكربونية من مجموعة الألكاينات ؛ حيث يحتوي على ذرتين من الكربون التي ترتبط برابطة ثلاثية، وهو غاز عديم اللون، وقابل للاشتعال، ويستخدم بشكل واسع في اللحام (بالإنجليزية: oxyacetylene)، وقطع المعادن، ويدخل كمادة خام في صناعة المواد الكيميائية العضوية، والبلاستيك، والصيغة الكيميائية لهذا الغاز هي C2H2. يمتاز غاز الأسيتيلين بأنه عديم اللون وذو رائحة لطيفة، لكن إذا تم تحضيره من كربيد الكالسيوم فإنه قد يحتوي