سترات الصوديوم إنّ سترات الصوديوم هو أحد المركبات الكيميائية التي تنتج من تفاعل كميات ستوكيومترية من محلول حامض الستريك مع هيدروكسيد الصوديوم، وعند تعرضه لدرجات حرارة عالية يتبخر المحلول وتتكون بلورات بيضاء من الملح، ويطلق على هذه البلورات سترات الصوديوم يحمل صيغة كيميائية: (Na3C6H5O7)، ومن الصيغة الكيميائية هو ملح الصوديوم الثلاثي لحمض الستريك. يتصف هذا الملح بأنّه مسحوق بلوري لا لون ولا رائحة له، ويحتوي في بنية البلورية على جزيء الماء الذي فقدهما مع التسخين عند حرارة 150 درجة مئوية، ومن
المركبات الكيميائية المركب الكيميائي هو عبارةٌ عن مادةٍ كيميائيةٍ تتكون من اثنين أو أكثرَ من العناصر الكيميائة المختلفة كيميائياً مع نسبةٍ ثابتةٍ تحدد التكوين، وعادةً ما يُعبَّر عن نسبةِ كل عنصرٍ بالصيغة الكيميائية، فعلى سبيل المثال الماء صيغته الكيميائية هي (H2O)، وهو مركبٌ يتكونُ من ذرتي هيدروجين مرتبطةٌ مع ذرةِ أكسجين، والذرات الموجودة في المركبات الكيميائية تتجمعُ معاً بسبب مجموعاتٍ متنوعةٍ من التفاعلات، فعلى سبيل المثال التفاعل الحادث في الماء (H2O) يحدث عن طريق الرابطة التساهمية القطبية،
الخليط يتكون الخليط من مادتين مختلفتين أو أكثر، بدون تكوين مادةً جديدةً، وهو نوعان، النوع الأول الخليط المتجانس، بحيث يتكوّن من مادتين أو أكثر، ولا يمكن التمييز بين هذه المواد بالعين المجردة، بحيث يكون الخليط متماثل الخواص مثل اللون والشكل والتركيب، مثل محلول السكر في الماء، والنوع الثاني الخليط غير المتجانس، وهو عكس الخليط المتجانس، حيث يمكن التمييز بين المواد المكوّنة له بالعين المجردة، لأنها غير متماثلة في الخصائص، مثل خليط من الماء والزيت. فصل مكوّنات الخليط غير المتجانس طرق فصل مكوّنات
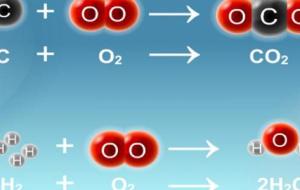
غاز ثاني أكسيد الكربون غاز ثاني أكسيد الكربون (الرمز الكيميائي: CO2)، هو غاز عديم اللون، وله رائحة خفيفة، وطعم حامض، وهو من المكونات الثانوية للغلاف الجوي لكوكب الأرض، حيث يقوم هذا الغاز بالاحتفاظ ببعض الطاقة الإشعاعية التي يتلقاها الكوكب، وبالتالي فهو يحافظ على حرارة الأرض، وبدونه ستكون الأرض باردة بشكل لا يطاق، ولكن ارتفاع مستوياته، يسبب ارتفاع درجات الحرارة، مما يؤدي إلى ما يعرف بظاهرة الاحتباس الحراري ،، ويتم إطلاقه في الغلاف الجوي من العمليات الطبيعية مثل التنفس ، والثورات البركانية،
الزِّنْك الزنك هو عنصر كيميائيّ يرمز له بالرمز Zn، ويندرج تحت سلسلة الفلزات الانتقالية في المجموعة الثانية عشرة، ورقمه الذريّ 30، ويعدّ من العناصر الأربعة والعشرين الأكثر توفراً في قشرة الكرة الأرضيّة، ومن أشهر خاماته وأكثرها استخداماً هو سيلفيرات الزنك، وكبريت الزنك، والسميثسونايت، كما يتواجد في العديد من الأغذية مثل المكسرات، والبذور، واللحوم وبخاصّة لحوم الكائنات البحريّة، وله خمسة نظائر في حالة الاستقرار، وللزنك أسماء أخرى فيسمّى في عالم الكيميائيين العرب بالخارصين، ويعرف أيضاً باسم
عناصر كيميائية هي مادة كيميائيّة تتكوّن من ذرات، ويتماثل فيها عدد البروتونات في نواتها مع العدد الذري لها، حيث يوجد 118 عنصراً كيميائيّاً تم تحديد جميع خصائصها؛ ويمكن العثور على 94 عنصراً منها بشكل حر في الطبيعة، و24 عنصراً هي اصطناعيّة، كما أنّ 80 عنصراً تمتلك نظائر مستقرّة، و38 تمتلك نظائر مشعّة، في حين أنّ بقية العناصر تضمحل مع مرور الوقت. الاكتشاف منذ الزمن القديم كان يوجد عدد من العناصر المألوفة عند إنسان ما قبل التاريخ أمثال (الكربون، والنحاس، والذهب، والحديد، والرصاص، والزئبق، والفضة،
العناصر القابلة للتمغنط العناصر القابلة للتمغنط هي مواد تستطيع أن تولد حقلاً مغناطيسياً فيها، وبالتالي تتولد لديها القدرة على جذب المواد الممغنطة إليها، وتقاس مغناطيسية أي مادة ممغنطة بقيمة العزم المغناطيسي في المتر المكعب فيها، ويرمز لها عادة بالرمز M، ووحدتها أمبير/متر. يمكن مغنطة مادة مغناطيسية على اختلاف أماكنها وباتجاه مختلف عن المغناطيسية، وتتم عملية مغنطة المواد من خلال مجموعة من الطرق المختلفة؛ وهي: المغنطة بالدلك أو الاحتكاك، والمغنطة بالتأثير أو الحث، والمغنطة بالكهرباء، وسنعرفكم في
عناصر المجموعة السادسة عناصر المجموعة السادسة من الجدول الدوريّ تبدأ من الأعلى للأسفل على الترتيب؛ وهي: الأكسجين (O) والذي يحمل العدد الذريّ 8، يليه الكبريت (S) ويحمل العدد الذريّ 16، والسيلينوم (Se) بالعدد الذريّ 34، والتيليريوم (Te) بالعدد الذريّ 52، والبولونيوم بالعدد الذريّ 84، وسنعرض في هذا المقال خصائصها، واستخدامات كل منها. خصائص المجموعة السادسة الخاصية اللافلزية تقلّ في المجموعة بدءاً من الأعلى للأسفل؛ أي بازدياد العدد الذريّ، حيث يُلاحظ أنّ الأكسجين، والكبريت، والسيلينيوم ضمن
عناصر المجموعة الثانية في الجدول الدوريّ البيريليوم البيريليوم (بالإنجليزية: Beryllium) هو معدن ذو لون أبيض فضي، ويتواجد في 30 نوعاً مختلفاً من المعادن، ومن أهمّها: البيرترانديت، والبيريل، ويُعدّ كل من الزمرد والزبرجد أحد أشكال البيريل الثمينة، وهو معدن ذو كثافة منخفضة، ولأنّ خلط البيريليوم مع معادن النحاس والنيكيل يزيد من موصليتها الكهربائية والحرارية، لذا فهي تُستخدَم في صناعة السبائك والتي تستخدَم في صنع المداور، والنوابض، والمماسات الكهربائية، وصناعة أقطاب اللحام؛ كما تُستخدَم هذه السبائك
الجدول الدوري للعناصر يُعرَّف الجدول الدوري للعناصر (بالإنجليزية: Periodic table) بأنه الجدول المنظم لكافة العناصر الكيميائية وفق زيادة العدد الذري لها من اليسار إلى اليمين، ومن الأعلى للأسفل، ويتوافق هذا التنظيم مع زيادة الكتلة الذرية للعناصر بشكل عام أيضاً، ويُطلق على عناصر العمود نفسه في الجدول الدوري اسم المجموعة ، والتي تتوزع فيها إلكترونات التكافؤ بصورة متشابهة، مما يعني أنها تملك تصرفات كيميائية متشابهة أيضاً، بينما تسمى الصفوف في الجدول الدوري بالدورات، والتي يشير رقمها إلى أعلى مستوى
المجموعة الثالثة في الجدول الدوري المجموعة الثالثة في الجدول الدوري هي العمود الثالث عشر في الجدول الدوري للعناصر حسب شكل الجدول الدوري المقرر من قبل الاتحاد الدولي للكيمياء، ويطلق عليها اسم مجموعة البورون، وتنضم عناصر هذه المجموعة للعناصر الفلزية باستنثاء عنصر واحد فهو من اللافلزات، وأهمّ ما يميّزها أنّها تحتوي على ثلاثة إلكترونات في الغلاف الخارجي لمدارها الأخير، وتتكوّن المجموعة الثالثة من خمسة عناصر كيميائيّة هي: البورون، والألمنيوم، والغاليوم، والإنديوم، والثاليوم. الخصائص العامة لعناصر
الكيمياء تُعرف الكيمياء بأنها علم يدرس العناصر الكيميائية وموادّها، وتدرس خواصها وبنائها وتركيبها وتحويلاتها المتبادلة والتغيرات التي تطرأ عليها، وتكمن أهميتها في دخولها في شتى مجالات حياتنا؛ حيث تعمل على تحويل المواد الخام إلى مواد جيدة يحتاجها الإنسان، وتعمل على توفير الأصباغ، والعطور، والمطاط، وأيضاً تساهم في القطاع الزراعي من خلال الأسمدة، والمبيدات، وبواسطتها نستطيع إنتاج الألياف الصناعية كالمنسوجات، وغيرها الكثير من الفوائد. مراحل علم الكيمياء مرحلة علم الصنعة، وهي المرحلة التي نشأت فيها
الجدول الدوري للعناصر يُعدّ المخترع والكيميائي الروسي ديمتري مندليف (بالإنجليزيّة: Dmitri Mendeleev) مؤسّس الجدول الدوري وفق الجمعية الملكية للكيمياء، ويُعرَّف الجدول الدوري (بالإنجليزيّة: Periodic Table) بأنه جدول تُرتَّب فيه العناصر الكيميائية المعروفة جميعها على هيئة مصفوفة؛ وفق زيادة العدد الذري لها من اليسار إلى اليمين، ومن الأعلى إلى الأسفل، وبشكل عام فإنّ هذا الترتيب يتوافق أيضاً مع زيادة الكتلة الذرية للعناصر، ويُطلَق على الصفوف في الجدول الدوري اسم الدورات، ويشير رقم الدورة لعنصرٍ ما
العناصر القلوية تشمل هذه المجموعة العناصر الآتية: الليثيوم، والصوديوم، والبوتاسيوم، والروبيديوم، والسيزيوم، والفرنسيوم، وتمتلك في مدارها الأخير إلكتروناً واحداً، وهي عناصر معدنية صلبة، وبرّاقة، وتعد موصلة جيدة للحرارة، والكهرباء، ولا يعد الهيدروجين من العناصر القلوية لأنه لا يمتلك عناصر مماثلة لهذه المجموعة، إلا أنه تحت ظروف معينة من الضغط والحرارة يمكن اعتباره عنصراً قلوياً. العناصر القلوية الترابية تتكون العناصر القلوية الترابية من ستة عناصر تحتل المجموعة الثانية من الجدول الدوري، وهذه
عنصر الكربون ينتمي الكربون إلى مجموعة اللافلزات، وهو من العناصر رباعية التكافؤ، أي أن له أربعة إلكترونات مخصصة من أجل تكوين روابط تساهمية، ويمكن أن يرتبط الكربون مع عناصر أخرى من الكربون مشكلاً بذلك سلسلة لانهائية من الكربون، كما يمكن أن يرتبط مع أنواع أخرى من العناصر مشكلاً بذلك عدداً كبيراً جداً من المركبات الكيميائية، ويوجد الكربون في كافة أنواع الحياة العضوية، ويعتبر العنصر الأساسي للكيمياء العضوية، كما يوجد بصيغ لا عضوية في عدد من المركبات؛ مثل: تنائي أكسيد الكربون، وملح الكربونات. عدد
الذّرّة تُعرّف الذّرّة على أنّها أصغر ما يمكن الوصول إليه في العنصر الكيميائيّ مع الاحتفاظ بالخصائص الكيميائيّة للعنصر، واعتُقِد قديماً أن الذّرّة غير قابلةٍ للانقسام وأنّها أصغر شيء في الوجود، ومن هنا أُطلِق عليها اسم أتوموس في اللغة الإغريقية ويقابلها (atom) في اللغة الإنجليزيّة. مع تطوّر العلم توصّل العلماء إلى أنّ الذّرّة تحتوي على عددٍ من الشّحنات السّالبة وتُعرف بالإلكترونات، وتدور حول النّواة التي تحمل شحنةً موجبةً؛ وذلك نظراً لاحتوائها على عددٍ من البروتونات الموجبة، وعدد من
غاز الهيدروجين يعد الهيدروجين من العناصر الكيميائية يرمز له بالرمز H، فهو من العناصر الخفيفة المتوفر بكثرة في الطبيعة، ولا لون ولا رائحة ولا طعم له ولا يمكن وجوده منفرداً في الطبيعة بل يكون متحداً ليشكل المركبات الكيميائية المختلفة سواء كانت بالحالة الغازية كالغاز الطبيعي، أم السائلة كالماء أم الصلبة مثل المركبات الهيدروكربونية، وبما أنّ غاز الهيدروجين من الغازات الخفيفة حيث إنّه لا يطلق غازات عند حرقه لذا أصبح مؤهلاً لأن يكون وقوداً للمستقبل. يستخدم غاز الهيدروجين في العديد من المجلات مثل
المخاليط والمحاليل توجد معظم المواد حولنا على شكل مزيج متجانس أو غير متجانس من مادتين نقيتين أو أكثر، بنسب مختلفة ومن دون روابط كيميائية بين العناصر أو المركبات، وبالتالي يحتفظ كل عنصر بشكله وخواصه الفردية السابقة قبل وضعه في المزيج أو المخلوط، ومن الممكن إعادة فصله باستخدام الطرق الكيميائية والفيزيائية. أنواع المخاليط من أنواع المخاليط ما يلي: مخاليط غير متجانسة (خليط هتروجيني): أي يمكن رؤية مادتين على الأقل بالعين المجردة، مثل: خليط الملح والفلفل، وخليط الماء والزيت، ويتميز الخليط غير
المعادن تعتبر المعادن واحدة من أهمّ الثروات الطبيعيّة التي سعى الإنسان منذ أن خلقه الله تعالى إلى توظيفها واستعمالها من أجل صنع أدوات تساعده على القيام بمهامه اليوميّة التي يحتاج إلى القيام بها حتى يستطيع البقاء على قيد الحياة، وهناك العديد من أنواع المعادن لكل معدن استعمال واستخدام لغرض معين، فهناك الحديد، والفضة، والذهب، والنحاس ... إلخ. تتوزّع المعادن في مختلف مناطق الكرة الأرضيّة، كما أنّ نسب هذه المعادن مختلفة من معدن إلى آخر، فبعض المعادن نادر كالذهب، والبعض الآخر واسع الانتشار كالحديد،
الكيمياء الكيمياء هي علمُ المادة، ويَشمل خصائص المادة وبنية جزئياتها، وتركيبها، وسلوكها، وتفاعلاتها مع المواد الأخرى، وتُسمّى الكيمياء أيضاً العلم المركزي؛ لأنّها تربط الفيزياء بالعلوم الطبيعية، مثل: الفلك، وعلم الأحياء، وعلوم الأرض. للكيمياء فروعٌ كثيرةٌ منها: الكيمياء العضوية، واللاعضوية، والفيزيائية، والتحليلية وغيرها. تطوُّر طُرقِ التدريس يعتمد تدريس الكيمياء على طُرقٍ تُؤدّي إلى فهم الطالب للمُحاضرات النظرية، وكذلك التّجارب العلمية التي تجري في المختبرات، وقد حصل تطوُّرٌ كبيرٌ في طرقِ
مواد النانو مواد النانو عبارة عن مواد كيميائية متناهية في الصغر تستخدم بجودة عالية في العديد من التطبيقات الصناعية كالاتصالات والإلكترونيات والمجالات الطبية لاحتوائها على العديد من الخصائص الفيزيائية والكيميائية، ويتم تحضيرها بعدة طرق تشترك جميعها باعتمادها على المقياس الذري أي ذرة اتجاه ذرةً أخرى للحصول على نتائج مرغوبة، وكلما اختلف مقياس الحجم لكتلة المادة اختلفت الفعالية الكيميائية بمعنى كلما صغر المقياس زادت الفعالية الكيميائية للمادة. طرق تحضير مواد النانو الطرق الفيزيائية يتم تحضيرها
عملية الفصل الكيميائية تعرف عملية الفصل الكيميائي بأنها عملية تحويل مزيج من المواد الخام إلى مواد أكثر نفعاً وفائدة، فهي من أبرز عمليات الهندسة الكيميائية، إذ يتكون هذا الخليط من مواد تختلف في خواصها الكيميائية والفيزيائية والتشكيل البلوري لها، و توجد بشكلٍ غير نقي، ثم تتحول إلى مواد خام أولية يسهل استخدامها في الصناعة. هناك العديد من طرق الفصل الكيميائية المتنوعة؛ كالامتصاص، والطرد المركزي، والترويق، والتبلور، والاستشراد الكهربائي، وإزالة الرطوبة، والفصل المغناطيسي، والتنخيل، والتسامي،
الهندسة الكيميائيّة الهندسة الكيميائيّة علم من علوم الهندسة المتطورّة، والذي يختص بشكل خاص في العمليّات الصناعيّة الكيميائيّة، والعمليات التحويليّة، وتطويرها؛ وقد تمّ إنشاء الكثير من المصانع المتخصّصة في هذا المجال، لإنشاء تفاعلات كيميائيّة خاصّة وبالتالي العمل على تطوير الكثير من الصناعات والمجالات الحياتيّة المختلفة؛ كعملية الفصل، وعمليات انتقال المادّة، وانتقال الحرارة والكتلة، وغيرها من العمليّات، ومن أهمّ المنتجات التي يمكن الاستفادة من الهندسة الكيميائيّة فيه الصناعات النفطيّة، والصناعات
الفصل الكروماتوجرافي يعرف باللغةِ العَربية باسمِ (الاستشراب)، وأيضاً يطلقُ عليه مسمى تفريق الألوان، وهو عبارةٌ عن طريقةٍ تستخدمُ لفصلِ المواد، والعناصر الكيميائيّة المختلطة مع بعضها البعض، وتعتمدُ على فكرة توزيع المكوّنات الكيميائيّة على نسبٍ مختلفةٍ من الممكن فصلها بسهولةٍ طالما توفّرت كافة الأدوات، والوسائل التي تساعدُ في ذلك، ومن الأمثلة على المواد التي من الممكن فصلها: فصل المواد الصلبة عن السائلة، وفصل المواد الصلبة عن الغازيّة. تعودُ الدراسات الأولى المرتبطة بهذا الأسلوب في فصلِ المواد