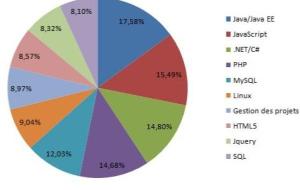
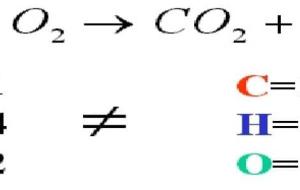تحضير حمض النيتريك عُرِف تحضير حمض النيتريك منذ زمنٍ بعيدٍ بطرقٍ عدة، وتُنسب الطريقة الأولى إلى الكيميائي الألماني يوهان رودولف غلاوبر (بالألمانية: Johann Rudolf Glauber) في العام 1648م التي استخدمت لسنوات عديدة، وفيما يأتي خطوات التحضير: يتم وضع 50 غم من نترات الصوديوم، أو نترات البوتاسيوم مع 30 غم من حمض الكبريتيك المُركّز في جهاز تقطير. بعد الانتهاء من التقطير ينتج 90-95% من حمض النيتريك عديم اللون. إذا كان الحمض الناتج ذا لون أصفر أو أحمر بسبب وجود أكاسيد النيتروجين المُذابة فيه، يتم ضخ
تجمّد الماء يتجمّد الماء عند نقطة معينة تسمّى نقطة تجمد الماء، حيث يتحوّل الماء عندها من الحالة السائلة إلى الحالة الصلبة، ويعاكسه نقطة الانصهار التي تشير إلى تلك الحرارة التي يتحول فيها الماء من الحالة الصلبة إلى الحالة السائلة، وتعد درجة حرارة صفر مئوية (32 فهرنهايت) هي نقطة تجمّد الماء، وعادةً ما يحدث كلٌ من التجمد والانصهار عند درجة حرارة واحدة، ولكن في بعض الحالات قد يبقى الماء في حالته السائلة حتى وإن كانت درجة الحرارة ما بين 40-42 فهرنهايت تحت الصفر، وذلك عند حدوث التبريد الفائق
تجارب كيميائية غريبة يوجد العديد من التجارب الكيميائية الغريبة التي يمكن تجربتها، ومنها ما يأتي: تجربة أفعى الصابون الضخمة يمكن تنفيذ تجربة أفعى الصابون الضخمة، والتي تُعرف أيضاً باسم معجون أسنان الفيل لأنها تنتج عموداً ضخم من الرغوة باتباع الخطوات الآتية: إرتداء نظارات واقية وقفازات. إضافة 100 مل من الصابون السائل إلى أنبوب طويل. إضافة 125 مل من بيروكسيد الهيدروجين بتركيز 30% للأنبوب. إضافة 50 مل من يوديد البوتاسيوم المشبّع إلى الأنبوب بحذر. إضافة القليل من ملون الطعام (اختياري). ملاحظة:
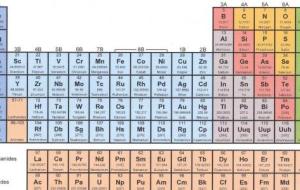
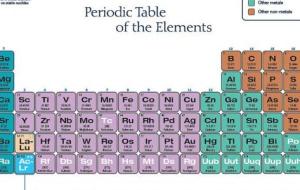
تصنيف العناصر بدأ العلماء بتصنيف وتنظيم العناصر المعروفة منذ العصور القديمة، والتي كانت حوالي 63 عنصراً، مثل: الذهب، والفضة، والقصدير، والرصاص، والنحاس، والزئبق، ومن ثم تم اكتشاف عنصر الفوسفور في عام 1669م، والعديد من العناصر على مدى 220 سنة، وخلال هذا الوقت، قام العلماء بتحديد الكتل الخاصة بالعناصر، وتعلموا العديد من الخصائص الكيميائية الأخرى، وذلك من خلال تعريض العناصر الفردية لمواد كيميائية مختلفة بطريقة منهجية، ومراقبة التفاعلات التي تحدث بينها، ومع زيادة كمية المعلومات التي تم معرفتها عن
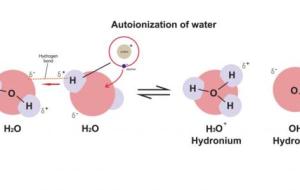
مفهوم تأيّن الماء تتفاعل جزيئات الماء مع بعضها كما تتفاعل الحموض والقواعد مع بعضها؛ حيث تتبادل كمية قليلة من جزيئات الماء البروتونات بينها فيما يعرف بالتأين الذاتي للماء كما في المعادلة الآتية: H2O H2O⇌ H3O OH حيث إن إحدى جزيئات الماء منح بروتوناً وتصرف كحمض حسب مفهوم برونستد-لوري (Bronsted-lowry acid)، أما الجزيء الآخر استقبل هذا البروتون وتصرف كقاعدة حسب مفهوم برونستد-لوري (Bronsted-Lowry base)، وبالتالي تتكون أيونات الهيدرونيوم H3O وأيونات الهيدروكسيد OH بنسبة مولية 1:1، وفي أي عينة من
المعادلة المتوازنة المعادلة المتوازنة هي معادلة كيميائية يتم من خلالها وصف تفاعل كيميائي قائم، حيث يكون عدد الذرات لكل عنصر من العناصر المتفاعلة، ومجموع الشحنة الكلية متساوٍ في كلّ من المواد المتفاعلة والمواد الناتجة عن التفاعل، وبمعنى آخر تتساوى كتلة العناصر وشحنتها على طرفي المعادلة. موازنة المعادلات الكيميائيّة لتقوم بكتابة معادلة كيميائية لتفاعل معين بشكل صحيح ومتوازن، يجب أن يكون عدد ذرات العناصر في الجانب الأيسر للمعادلة مساوٍ لعدد الذرات على الجانب الأيمن، فعلى سبيل المثال عند تفاعل
غاز النيتروجين النيتروجين هو أحد العناصر الكيميائيّة، ويكون على هيئة غاز في الوضع الطبيعي، ويرمز له بالرمز N، ويمتلك سبعة إلكترونات في مداراته، وهو عنصر لافلزي، ويتواجد على شكل جزيئات N2، وليس له لون، ولا رائحة، وهو مكوّن في العديد من المركبات الهامّة مثل الأمونيا، كما أنّه مكوّن مهمّ في الأحماض النووية التي تحمل جينات وصفات الكائنات الحيّة المختلفة. اكتشاف النيتروجين اكتشف العالم دانيال رذرفورد عنصر النيتروجين، وقد كان من قبله جابر بن حيّان يتعامل مع مركبات النيتروجين مثل حمص النتريك وقد كان
الكيمياء الكيمياء كلمةٌ عربيّةٌ مأخوذةٌ من الفعل كَمَى، أي خبأ وستر الشيء عن الآخرين؛ وسميّ هذا العلم بالكيمياء لأنّ من اشتغل به منذ قديم الأزل كان يخفي معلوماته وأسراره عن الآخرين، أمّا التعريف العلميّ للكيمياء فهو العلم الطبيعيّ المركزيّ الذي يُعتبر حلقة وصلٍ بين مختلف العلوم الطبيعية؛ كالفيزياء، والجيولوجيا، والطِّب، والصَّيدلة. والكيمياء علمٌ يدرُس المادّة بحالاتها الثَّلاث؛ الجامدة، والسّائلة، والغازيّة، من حيث عدد الذّرات وتركيبها وتفاعلاتها مع غيرها من العناصر والمُركبّات، ويدّرُس طاقة
المادة المادة هي كلّ ما يشغله الحيّز من فراغ، ولها حجم وكتلة يمكن قياسها، كالماء والهواء والأجسام وغيرها، كما تتكوّن المادة من جسيمات صغيرة جداً عرفت بالجزيئات، وقد أدى التطوّر العلمي إلى اكتشاف المادة وأجزائها وجسيماتها، وتمتلك المادة العديد من الخصائص والمتغيّرات، التي سنتحدث عنها في هذا المقال. حالات المادة الحالة الصلبة: تتميّز هذه المادة بأن جزيئاتها تتخّذ حجماً وشكلاً مميّزاً، وتعرف عمليّة الانصهار بأنّها تحوّل المادة من الحالة الصلبة إلى الحالة السائلة. الحالة السائلة: تتخّذ جزيئات هذه
بحث عن خواص العناصر عندما نقول إنّ للمادة خصائص فهذا بالضرورة ينحصر في المعنى بين الخصائص الفيزيائية والكيميائية، حيث تُعنى الخصائص الفيزيائية بحالة المادة دون أي تغير بتركيبتها، حيث تنطوي على خواص عامة مثل اللون والكثافة والصلابة، وفيما يتعلق بالخصائص الكيميائية فإنها متعلقة بوصف حالة المادة عندما تتغير من حالة إلى حالة أخرى لتصبح مادة أخرى مغايرة عن الأصل مثل خاصية الاشتعال والتأكسد (صدأ الحديد) والمقاومة. إنّ المقارنة بين الخصائص الكيميائية والفيزيائية ستوضح أن الفرق بينهما واضح، لكن في حال
تفاعلات الاحتراق تفاعلات الاحتراق (بالإنجليزية: Combustion reactions) هي تفاعل أيّ مادّة قابلة للاشتعال مع مادّة تعمل على التأكسد، لتكوين مُنتج مُؤكسد، بحيثُ تحصل عادةً عندما يتفاعل الأكسجين (O2) مع الهيدروجين (H) والكربون (C) لإنتاج بخار الماء (H2O) وثاني أكسيد الكربون (CO2)، كما وأنّها فئة رئيسية من التفاعلات الكيميائية ، وهي تفاعلات طاردة للحرارة، أي أنّها تقوم بإنتاج الطاقة، كما ويُعتبر اللّهب في تفاعلات الاحتراق مؤشراً مُميّزاً للتفاعل، حيثُ تُوفّر الحرارة القادمة من اللهب طاقة كافية لجعل
سعى الإنسان إلى إيجاد المعالم الأساسية على سطح الأرض وكتابة التصنيفات الخاصة بثروات الأرض وموادها فبدأ بتصنيفها وفقا للخواص التي تمتلكها فبدأ بتصنيفها على الوجه الفيزيائي الذي كان يراه منها ومن أشكالها، فصنفها أولا وفقا لحجمها ولونها، ثم زاد الدقة في ذلك فوضع عددا من الخواص الفيزيائية لتصنيفها كخدش السطح والصلابة والصلادة والمسامية والتفاعل مع الهواء والماء وغير ذلك من الصفات الأساسية التي عني بها الفيزيائيون والكيميائيون على حد سواء، ثم بعد ذلك تطور العمل على إيجاد تصنيف أكثر دقة وظهر بعد
تصنيف العناصر قامت العديد من المحاولات من أجل تصنيف العناصر في جداول لتسهيل دراستها، ومن ضمن هذه المحاولات محاولة برزيليوس الذي قسم العناصر إلى فلزات ولا فلزات، ومحاولة منديلف الذي ريتب العناصر ترتيباً تصاعدياً بحسب إعدادها الذرية، إضافة إلى الجدول الدوري الطويل الذي رتب العناصر بشكل يتفق مع مبدأ البناء التصاعدي، والذي يتم اعتماده حالياً في الدراسة والبحث. الجدول الدوري يشتمل الجدول الدوري على سبع دورات أفقية، بحيث توجد ثماني مجموعات رأسية تُشكل عناصر المجموعة A، كما توجد عشر مجموعات رأسية
تعتبر المادة أساس تكوين أي عنصر ، كما أن المادة بطبيعتها تتكون من وحدات بناء صغيرة جداً لا يكمن رؤيتها بالعين المجردة ، وهي الجزيئات ، والجزيئات تتكون من الذرات ، وشنناقش كل واحدة على حدى : - الجزئ : يتكون الجزئ من ذرتين على الأقل من نفس المادة ، أو من مواد أخرى في بعض الأحيان . - الذرة : وهي أصغر جزء في المادة ، وهي الجزء الذي لا يتجزأ . خصائص الجزيئات :- تكون الجزيئات في حالة نشاط دائم ، حيث أنها تمتاز بالحركة المستمرة ، وتكون في المواد الصلبة ذات حركة محدودة جداً أو كما يعرف بالحركة
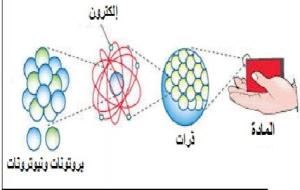
الذرة الذرة هي أصغر جزء من العنصر الكيميائي والذي يحتفظ بالخصائص الكيميائية لذلك العنصر، وتتشكل الذرة من الشحنات السالبة، أي الإلكترونات التي تدور حول نواة موجبة الشحنة في المركز، وقد لقي تركيب الذرة اهتماماً كبيراً من قبل العلماء والباحثين، وأدى ذلك بهم إلى اكتشاف المزيد من الأمور عنها، فبرزت العديد من الفروع الجديدة في العلم، والتي تحمل نظريات خاصة بها، وسنعرفكم في هذا المقال على تركيب الذرة. تركيب الذرة تتركب الذرة من عدة مكوّنات هي: النواة، والإلكترونات التي تتحرك في أغلفة مدارية، وتبعد
الكيمياء والمادّة الكيمياء أوعلم المادّة هو العلم الذي يدرس ويهتم بتركيب، وبنيّة، وسلوكيات، وخصائص، وتفاعلات المادّة، وكذلك تداخلاتها، كما يُطلق عليها أيضاً اسم العلم المركزي، حيث إنّ الكيمياء تربط علم الفيزياء بالعلوم الأخرى الطبيعية؛ كعلم الأحياء، وعلم الفلك، وعلم الجيولوجيا. تعريفات علم الكيمياء توجد عدة تعريفات لعلم الكيمياء تطورّت شيئاً فشيئاً عبر السنين، وهي على النحو التالي: تعريف زوسيموس لعلم الكيمياء: هو دراسة تركيب الماء، والحركة، والنمو، والتجسّد. عرفها روبرت بويل عام 1661م بأنّها:
أهمية الكيمياء في حياتنا تكمُن أهميّة الكيمياء بارتباطها الوثيق في مُختلف الحقول في الحياة، ويُمكن تلخيص بعضها كالآتي: الصحّة والجمال: عملت الكيمياء على تحقيق رغبة الإنسان بعيش حياة أفضل وأطول، وتمّ ذلك بتحسين القُدرة الجسمانيّة على مقاومة الأمراض، عن طريق استخدام اللقاحات، بالإضافة إلى محاولة الوصول للتشخيصات السليمة لهذه الأمراض بإجراء التحليلات المخبريّة اللازمة. طهي الطعام: من خلال دراسة مكوّنات الطعام، والتفاعلات الكيميائيّة التي تحدث بين هذه المكوّنات أثناء الطهي، وتُقدّم الكيمياء
الكيمياء يمكننا تعريف الكيمياء على أنها علم المادة الذي يبحث في بنية وتركيب وخواص وسلوك وتفاعل المادة بالإضافة إلى تداخلاتها التي تُحدثها، يُطلق على الكيمياء في بعض الأحيان اسم العلم المركزي كونها تربط الفيزياء بالعلوم الطبيعية الآخرى مثل علم الجيلوجيا والفلك وعلم الأحياء، وهناك من يعرفها على أنها العلم الذي يدرس خصائص المركبات والعناصر والقوانين التي تتحكم بتفاعلاتها عند اتّحادها مع بعض وهو ما يطلق عليه التركيب، وفصل بعضها عن بعض وهو التحليل. نظرية الكيمياء تبدأ الكيمياء بدراسة الأجسام
الغازات المادّة في علم الكيمياء هي الحالة التي تكون الذَّرات أو الجزيئات عليها في الطبيعة، وللمادّة ثلاث حالاتٍ هي: الحالة الصّلبة أو الجامدة، والحالة السَّائلة، والحالة الغازيّة. الغازات شكلٌ من أشكال المادة وهو من الموائع كالسوائل تماماً؛ وسُميّ مائعاً لأنه يمتاز بخاصّية الانتقال من مكانٍ إلى آخر، بالإضافة إلى أنّه يملأ الوعاء الذي يوضع فيه مهما كان حجمه. الغازات توجد في الطّبيعة على هيئة جزيئاتٍ ثنائيّةٍ مكونةٍ إما من ذراتٍ من نفس النَّوع كالغازات النَّبيلة- عناصر المجموعة الثَّامنة من
بحث عن العوامل المؤثرة في الذوبان الحرارة يتأثر الذوبان بالحرارة؛ بسبب دور الحرارة في تكسير الروابط الكيميائية وإعادة تكوينها أثناء عملية الذوبان ، لكن في حال كانت درجة الحرارة أعلى ممّا يلزم لكسر الروابط سيكون التفاعل طارداً للحرارة وستنخفض قابيلة الذوبان مع زيادة الحرارة، أمّا في حال كانت درجة الحرارة أقل من الحد الأقصى اللازم لتكسير الروابط وإعادة تكوينها فإنّ التفاعل يكون ماصاً للحرارة وارتفاع الحرارة سيعني زيادة قابلية الذوبان، وهي الحالة الأكثر شيوعاً. القطبية تُستقطَب الجزيئات عندما
العناصر والمركبات العناصر والمركبات هي أساس المادة، فالعنصر عبارة عن ذرة، وهي أصغر شيء في المادة، أمّا المركب فهو عبارة عن عنصرين أو أكثر، ومع اختلاف العناصر، واختلاف ترابطها، تتشكل العديد من المركبات، كما أنّ هذه المركبات تتحد مع بعضها لتشكل مواد مختلفة، وهكذا يتكون الوجود بما فيه، وتتفاعل الأشياء في الطبيعة في خدمة الإنسان. العناصر العنصر عبارة عن ذرة فريدة، لها عدد ذري، وهو عدد الإلكترونات في مدارات الطاقة لها، وتتكون من نواة تحتوي مجموعة من البروتونات، والنيوترونات، والبروتونات هي جسيمات
الطاقة تعتبر الطاقة من المواضيع الرئيسيّة التي تشغل الحكومات والدول نظراً لأهميّتها وحاجة السكان لها، وقد ازداد التركيز على مفهوم الطاقة ومصادرها بعد اكتشاف النفط والفحم الحجري، فاعتمد عليه الإنسان بشكلٍ أساسي للحصول على الخدمات وتأمين الاحتياجات الرئيسيّة. كما ظهرت الحاجة إلى توفير مصادر بديلة للنفط والفحم الحجري بوصفها مصادر غير متجددة وستنفذ يوماً ما، ولكن ما مفهوم الطاقة؟؟ وما هي أنواعها؟؟ وما هي المصادر التي من خلالها يمكن الحصول عليها؟؟ تعريف الطاقة لقد مرّ مفهوم الطاقة بالكثير من
غاز النيتروجين غاز النيتروجين (بالإنجليزيّة: Nitrogen) هو عنصر لا فلزي عديم اللون، والرائحة، والطعم من عناصر المجموعة الخامسة عشر، والذي يشار إليه بالرمز N، ويحمل العدد الذري 7، وهو العنصر الأكثر وفرةً في الغلاف الجوي للأرض، إذ يتكون أربعة أخماس الغلاف منه، بالإضافة إلى ذلك فإنه يعد العنصر السادس في الوفرة الكونية، ويشكل غاز النيتروجين في الغلاف الجوي المصدر الرئيسي له لأعمال التجارة والصناعة، كما يوجد في الغلاف أيضاً على شكل كميات صغيرة متغيرة من أملاح الأمونيوم، والأمونيا ، وحمض النيتريك،
المادة تُعرَّف المادة بأنها كل ما يشغل المساحة، ويمتلك كتلة، وتتكون كل الأجسام المادية من المادة، والتي تكون على شكل ذرات مكونة من بروتونات ، ونيوترونات، وإلكترونات، ويمكن أن تتواجد المادة في العديد من الحالات المختلفة كالحالة السائلة، أو الصلبة، أو الغازية، أو البلازما، أو بوز- آينشتاين، إذ تنتقل بين هذه الحالات بالاعتماد على كمية الحرارة التي تمتصها أو تطلقها، كما تنقسم المادة إلى ثلاثة فروع وفقاً لكيفية تجميع الذرات فيها، فهي تحدد خصائصها الكيميائية والفيزيائية، وهذه الفروع هي العناصر،