بحث عن وزن المعادلات الكيميائية
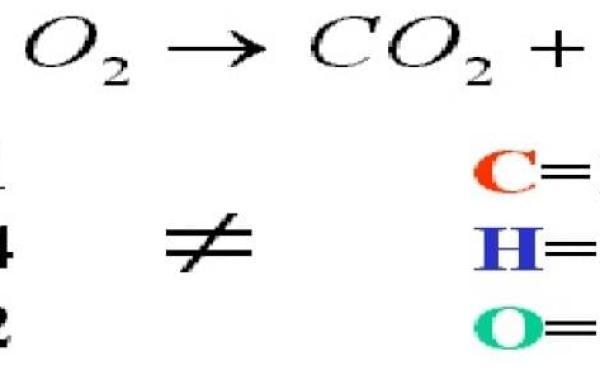
المعادلة المتوازنة
المعادلة المتوازنة هي معادلة كيميائية يتم من خلالها وصف تفاعل كيميائي قائم، حيث يكون عدد الذرات لكل عنصر من العناصر المتفاعلة، ومجموع الشحنة الكلية متساوٍ في كلّ من المواد المتفاعلة والمواد الناتجة عن التفاعل، وبمعنى آخر تتساوى كتلة العناصر وشحنتها على طرفي المعادلة.
موازنة المعادلات الكيميائيّة
لتقوم بكتابة معادلة كيميائية لتفاعل معين بشكل صحيح ومتوازن، يجب أن يكون عدد ذرات العناصر في الجانب الأيسر للمعادلة مساوٍ لعدد الذرات على الجانب الأيمن، فعلى سبيل المثال عند تفاعل ذرتي الهيدروجين مع الأكسجين نتج عن ذلك خسارة لذرة أكسجين O عندما تفاعلت مع ذرة الهيدروجين الثانية، وذلك بسبب التفاعل الكيميائي بين الذرات، إذ تم كسر الروابط الموجود في كلٍ من ذرتي الأكسجين O-O والروابط الموجودة بين ذرتي الهيدروجين H-H، لإنتاج الروابط بين الأكسجين والهيدروجين H-O، والمعادلة الموزونة ستكون على الشكل الأتي: 2H2 O2 → 2H2O، وفي المعادلات الكيميائية، فإنّ الرقم الموجود قبل رمز الجزيء (المعامل) يدل على عدد الجزيئات الداخلة في التفاعل، وإن لم يكن هناك أي رقم فهذا يعني تلقائياً بأنّ عدد الجزيئات هو واحد فقط.
موازنة معادلات الأكسدة والاختزال
تعتبر موازنة معادلات الأكسدة والاختزال أكثر تعقيداً بعض الشيء من المعادلات العادية، ومع ذلك فإنّها ما زالت تتبع بعض القوانين الأساسية في الموازنة، والطريقة التي سنتبعها للشرح عن كيفية وزن هذا النوع من المعادلات تسمى بأنصاف المعادلات، ويتم من خلالها فصل المعادلة إلى نصفين، معادلة واحدة للأكسدة والأخرى للاختزال، إذ تتم موازنة هذه المعادلات عن طريق التأكد من المعاملات وإضافة H2O، H ، إلكترون سالب e- كالتالي:
- موازنة عناصر المعادلة عدا العنصرين H وO.
- موازنة ذرات الأكسجين عن طريق إضافة العدد المناسب من جزيئات الماء للطرف الآخر من المعادلة.
- موازنة ذرات الهيدروجين بالإضافة إلى الذرات التي تمت إضافتهم لموازنة ذرة الأكسجين في الخطوة السابقة، عن طريق إضافة أيون H في الطرف الأخر من المعادلة.
- موازنة الشحنات بين طرفي المعادلة عن طريق إضافة الشحنة السالبة e- للطرف الموجب.
- وجوب تساوي الشحنات السالبة e- على طرفي المعادلة.
- جمع المعادلات النصفية معاً، مع حذف الإلكترونات والعناصر المشتركة بين الطرفين لتكوين معادلة متوازنة.
- ملاحظة: في حال تمت موازنة المعادلة في الوسط القاعدي يجب إضافة العدد المناسب من أيونات OH- إلى المعادلة لإعادة أيون H إلى جزيئات الماء.







