تأين الماء
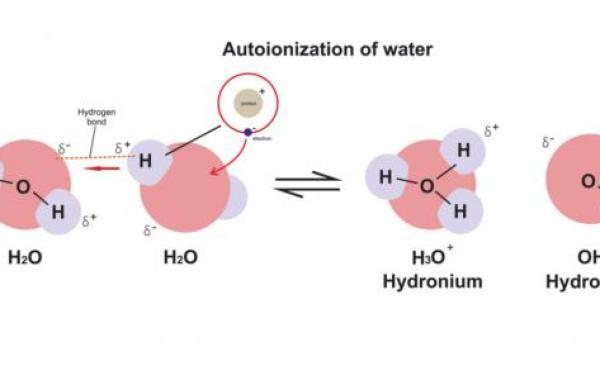
مفهوم تأيّن الماء
تتفاعل جزيئات الماء مع بعضها كما تتفاعل الحموض والقواعد مع بعضها؛ حيث تتبادل كمية قليلة من جزيئات الماء البروتونات بينها فيما يعرف بالتأين الذاتي للماء كما في المعادلة الآتية:
H2O H2O⇌ H3O OH
حيث إن إحدى جزيئات الماء منح بروتوناً وتصرف كحمض حسب مفهوم برونستد-لوري (Bronsted-lowry acid)، أما الجزيء الآخر استقبل هذا البروتون وتصرف كقاعدة حسب مفهوم برونستد-لوري (Bronsted-Lowry base)، وبالتالي تتكون أيونات الهيدرونيوم H3O وأيونات الهيدروكسيد OH بنسبة مولية 1:1، وفي أي عينة من الماء النقي يجب أن يتساوى التركيز المولي لأيونات الهيدرونيوم مع أيون الهيدروكسيد.
ملاحظات مهمة:
- الماء له خصائص الحمض والقاعدة ( بالإنجليزية: amphotric)، حيث يتصرف كقاعدة مع الحموض، وكحمض مع القواعد.
- العملية منعكسة في المعادلة؛ لأن الماء حمض ضعيف وقاعدة ضعيفة أيضاً.
- تركيز أيوني الهيدروكسيد والهيدرونيوم يكون قليلاً جداً بالنسبة إلى الكمية غير المتأينة من الماء.
ثابت تأيّن الماء
لإيجاد ثابت تأين الماء يتم اتباع الخطوات الآتية:
- من هذه المعادلة H2O H2O⇌ H3O OH عند تطبيق قانون الاتزان يتم الحصول على: [Kc=[H3O][OH] /[H2O.
- بما أن تركيز الماء يكون ثابتاً دائماً ويساوي 55.5 مول/ دسم، فإن ثابت تأين الماء (Kw) يساوي ((Kc*((55.5.
- وبالتالي [Kw = [OH] [H3O.
- عند قياس الموصلية للماء النقي لوحظ أن تركيز أيوني الهيدروكسيد والهيدرونيوم عند ْ25 سيليسيوس يساوي 10× 1 مول/ دسم.
- وبالتالي فإن (10×1)*(10×Kw= (1 ويساوي 10×1 مول/دسم.
- ملاحظة: يعتمد ثابت تأين الماء (Kw) على قوة الرابطة الهيدروجينية، وبالتالي فإنه يتأثر بنفس العوامل التي تتأثر بها الرابطة الهيدروجينية؛ مثل درجة الحرارة ، والضغط، وتركيز المذاب، والقوة الأيونية.
مثال لتوضيح تأيّن الماء
احسب تركيز أيون الهيدرونيوم في محلول مائي تركيزه 0.001 مولار، عند درجة حرارة ْ25 سيليسيوس.
الحل:
من هذه القاعدة يكون تركيز أيون الهيدرونيوم [Kw = [OH] [H3O
وبالتالي فإن تركيز أيون الهيدرونيوم يساوي (10)*1/ 0.001 ويساوي (10)*1 مولار.
أهمية تأين الماء في جسم الإنسان
بناءً على مبدأ التعادل الكهربائي فإن البلازما يجب أن تكون متعادلة كهربائياً، ومجموع الأيونات الموجبة فيها يساوي مجموع الأيونات السالبة، بالإضافة إلى أن أيونات الماء يجب أن تكون ثابتة، إلا أن اختلاف تركيز أيونات البلازما يؤدي إلى اختلاف النسبة بين الأيونات الموجبة والسالبة، ولكن ثبات تأين الماء يؤدي إلى الحفاظ على التعادل الكهربائي في البلازما واتزان الحموض والقواعد.







