شرح وزن المعادلات الكيميائية
المعادلة الكيميائية
المعادلة الكيميائية عبارة عن طريقة لكتابة التّفاعل الكيميائيّ، وتمثيله، والتعبير عنه باستخدام رموزٍ وصيغٍ كيميائية، بحيث تُبيّن المواد الدّاخلة في التّفاعل، والمواد الخارجة منه، كما تُبين الإلكترونات المُكتسبة أو المَفقودة من كلِّ ذرةِ عنصر من عناصر التّفاعل.
مثال على معادلة كيميائية
من الأمثلة على المعادلات الكيميائية القول مثلاً بأنّ غاز الميثان يتفاعلُ مع غاز الأكسجين، وينتج من ذلك التّفاعل غاز ثاني أكسيد الكربون والماء، أو يمكن كتابتها على شكل معادلة كيميائية بوضع رمز غاز الميثان وهو CH4 وإضافة إشارة ( ) ثُمّ وضع رمز غاز الأكسجين وهو O2 للتدليل على جزيئات المواد الداخلة في التّفاعل، ثم رسم سهم صغير يدلّ على اتجاه التفاعل للتعبير عن نواتج التّفاعل، ثم إتباعه برمز غاز ثاني أكسيد الكربون وهو CO2 ثم إشارة ( ) ورمز جزيء الماء وهو H2O للتعبير عن جزيئات المواد الخارجة من التفاعل، وذلك كما يأتي:
CH4 O2 → CO2 H2O
حيث إنّ CH4 O2 تعبر عن المواد الدّاخلة في التفاعل، و CO2 H2O تعبر عن المواد الخارجة من التّفاعل، والسّهم يُعبر عن اتّجاه التّفاعل، فتكون بذلك المعادلة الكيميائية للتفاعل طريقةً مُختصرةً وواضحةً لكتابة وقراءة التّفاعلات الكيميائيّة، والتّعبير عن المواد الدّاخلة والخارجة من التّفاعل، علماً أنّ المُعادلة الكيميائيّة تُقرأُ من اليَسار إلى اليمين.
طريقة وزن المعادلة الكيميائية
وزن المعادلة الكيميائية يَعني توضيح عدد الجزيئات الدّاخلة والخارجة من التّفاعل من كلِّ عنصرٍ من عناصر التّفاعل من خلال عدّ عددِ ذرّات العنصر الداخلة والخارجة من التفاعل وموازنتها؛ حيث إنّه يجب أن يتساوى عدد الذّرات الدّاخلة والخارجة في التفاعل من كل عنصر، ومن التفاعل السابق نلاحظ أنّ المعادلة غير موزونة CH4 O2 → CO2 H2O ولوزنها نتبع الخطوات التالية:
- نعدُّ الذرات الدّاخلة في التّفاعل من كلِّ عنصر، وأول عنصر هو الكربون ورمزه هو C والموجود في جزيء الميثان CH4، وثاني عنصر هو الهيدروجين ورمزه H وهو أيضاً في جزيء غاز الميثان، ولكن نلاحظ أن الرّقم الموجود يمين رمز الهيدروجين وهو 4 يدل على عدد ذرّات الهيدروجين المُرتبطة مع الكربون، فهناك ذرة كربون واحدة مرتبطة مع أربع ذرات من الهيدروجين لتُشكِّل جزيء الميثان CH4.
- نعدُّ عدد ذرّات الأكسجين ورمزه O الدّاخلة في التّفاعل، والتي ستتفاعل مع الميثان، ونجد أنّها ذرتان من الأكسجين؛ حيث إنّه عادةً ما يكون جزيء غاز الأكسجين على شكل ذرّتين من الأكسجين مُرتبطتين معاً في الطّبيعة، والرقم 2 الذي على يمين رمز الأكسجين يدلّ على ذلك.
- نَعدُّ بعدها الذرّات الخارجة من التّفاعل وهي التي بعد السهم المرسوم، ونبدأ بجزيء ثاني أكسيد الكربون CO2، وهو يحتوي ذرة كربون واحدة C، وذرّتي أكسجين كما يوضّح الرقم 2 الموجود يسار رمز O.
- نعدُّ ذرّات الجزيء الأخير من التّفاعل؛ وهو الماء H2O ونلُاحظ أنّه يحتوي على ذرّتي هيدروجين، كما يوضح الرقم 2 الموجود يسار رمز الهيدروجين H، ويحتوي على ذرة أكسجين واحدة.
- نُلاحظ أنّ عدد الذرّات الدّاخلة في التّفاعل من كلِّ عنصر غير متساوية مع عدد الذّرات الخارجة من التّفاعل من العنصر نفسه، حيث توجد ذرة كربون واحدة داخلة في التّفاعل، وذرة كربون واحدة خارجة من التّفاعل وهي بالتالي متساوية، ولكنّ عدد ذرات الأكسجين الدّاخلة في التّفاعل هو 2 في حين أنّ عدد ذرّات الأكسجين الخارجة منه هو 3؛ حيث إنّ هناك ذرّةً واحدةً في الماء وذرّتين في ثاني أكسيد الكربون، كما أنّ عدد ذرّات الهيدروجين الدّاخلة في التّفاعل هو 4، في حين أنّ عدد ذرات الهيدروجين الخارجة من التفاعل هو 2؛ حيث إن الميثان يحتوي على أربع ذرات في حين أنّ الماء يحتوي على اثنتين.
- نضاعف عدد بعض الجزيئات في المعادلة السابقة حتى يتساوى عدد الذرات الداخلة والخارجة من التفاعل؛ فبدلاً من جزيء أكسجين واحد يحتوي على ذرتين من عنصر الأكسجين، نُعدّل المعادلة ليدخل فيها جزيئان من الأكسجين، وفي كلّ جزيء ذرتان، وبالتالي تُصبح لدينا 4 ذرات أكسجين، ويصبح شكل المعادلة كالآتي: CH4 2O2 → CO2 H2O؛ حيث نُضيف رقم 2 على يسار رمز الأكسجين ليدل على عدد الجزيئات، فيصبح عدد ذرات الأكسجين الدّاخلة في التّفاعل هو 4 وعدد الذّرات الخارجة منه هو 3، ولمعادلة ذلك نُضيف رقم 2 إلى يسار جزيء الماء؛ للتعبير عن نتوج جزيئين من الماء من التّفاعل، وتصبح المعادلة كالأتي: CH4 2 O2 → CO2 2 H2O
- نلاحظ هنا أن عدد ذرات الاكسجين الداخلة في التفاعل هو 4، وعدد ذرات الأكسجين الخارجة منه هو أيضاً 4؛ حيث توجد ذرتان في جزيء ثاني أكسيد الكربون، وذرة واحدة في كل جزيء ماء.
- نُوازن في النّهاية عدد ذرات الهيدروجين، ونجد أن هناك 4 ذرات هيدروجين داخلة في التّفاعل، وهناك أيضاً 4 ذرات هيدروجين خارجة من التفاعل؛ حيث إنّ عدد ذرّات الهيدروجين الموجودة في جزيء الماء الواحد هو 2، ولكن بعد زيادة عدد جزيئات الماء إلى جزيئين أصبح عدد ذرات الهيدروجين 4، وهو بالتالي متساوٍ.
فتكون المعادلة قبل الوزن هي:
CH4 O2 → CO2 H2O.
وتصبح بعد الوزن:
CH4 2 O2 → CO2 2 H2O.
يعود السّبب لوزن المعادلات إلى أنّ أحد مبادئ العلوم الأساسيّة وهو قانون حفظ المادة يقول بأنّ (المادة لا تموت ولا تفنى، كما لا تُخلق ولا تُستحدث من العدم، وإنّما تنتقل وتتغيرُ من شكل إلى آخر) لذلك لا يُمكن حدوث تفاعل يُنتج مواد جديدة أو ذرات جديدة من العدم، بل يجب أن تكون نتجت من إحدى المواد الدّاخلة من التّفاعل، كما لا يُمكن لذرّاتٍ أن تفنى أو أن تختفي من التّفاعل، بل يجب أن تظهر جميع الذرّات كاملة العدد في نواتج التفاعل كما كانت في مُدخلات التّفاعل.
أمثلة على وزن المعادلة الكيميائية
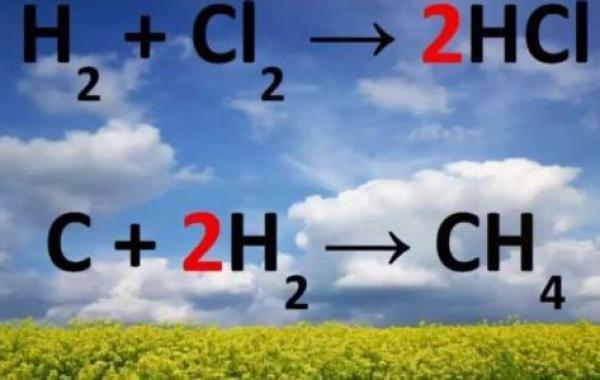
من أبسط الأمثلة على التفاعلات هو تفاعل واتحاد عنصر الهيدروجين مع عنصر الأكسجين؛ لتشكيل جزيء الماء بالتفاعل التالي:
H2 O2 → H2O
حيث يكون عنصر الهيدروجين مثل عنصر الأكسجين يرتبط على شكل جزيء يتكوّن من ذرتين في الطّبيعة، فنُلاحظ أنّ عدد ذرات الهيدروجين الداخلة في التفاعل هو 2 وعدد ذرات الأكسجين الداخلة في التفاعل هو أيضاً 2، ولكن عدد ذرّات الأكسجين الناتجة من التفاعل هو ذرة واحدة في حين أنّ عدد ذرات الهيدروجين الناتجة من التفاعل هو 2، ولجعل عدد ذرّات الأكسجين متساوية على طرفي التفاعل نضيف الرقم 2 إلى جانب جزيء الماء للتعبير عن نتوج جزيئين من الماء، وفي كلٍّ منهما ذرة أكسجين واحدة، فيصبح التفاعل على الشكل الآتي:
H2 O2 → 2 H2O
نلاحظ أنه على الرغم من أنّ عدد ذرات الأكسجين قد تساوى على طرفي المعادلة، فإنّ عدد ذرات الهيدروجين قد اختلف؛ فعدد الذّرات الداخلة في التفاعل ما زال 2 في حين أنّ عدد الذرات الخارجة من التّفاعل قد أصبح 4؛ حيث يحتوي كلُّ جزيءِ ماءٍ على ذرّتين من الهيدروجين، ولموازنة ذلك نضيف الرقم 2 بجانب جزيء غاز الهيدروجين؛ للتعبير عن دُخول جُزيئين منه في التّفاعل، فتصبح المُعادلة بشكلها الموزون:
2H2 O2 → 2 H2O
عند تفاعل الهيدروجين مع النيتروجين ورمزه هو N فإن الناتج هو الأمونيا، ويكتب التفاعل بالصّيغة غير الموزونة الآتية:
H2 N2 → NH3
نلاحظ أنّ عدد ذرات الهيدروجين الدّاخلة في التّفاعل هو 2 وعدد الذّرات الخارجة منه هو 3، وكذلك عدد ذرات النيتروجين الداخلة في التفاعل هو 2 في حين أن عدد الذرات الخارجة منه هو 1، ولوزن المعادلة نضيف الرقم 3؛ للتّعبير عن دخول ثلاثة جزيئات من الهيدروجين في التّفاعل، وفي كلٍّ منها ذرّتان من الهيدروجين، فيصبح الداخل في التّفاعل هو 6 ذرات هيدروجين كما في المعادلة الآتية:
3H2 N2 → NH3
نضيف الرقم 2 بجانب جزيء الأمونيا؛ للتعبير عن نتوج جزيئين من الأمونيا من التفاعل، وفي كلِّ واحدٍ منهما ثلاث ذراتٍ من الهيدروجين، فيصبح الناتج بذلك 6 ذرات من الهيدروجين، وتصبح المعادلة بشكلها الأخير والموزون:
3H2 N2 → 2 NH3
نلاحظ أنّ عدد ذرات النيتروجين قد أصبح موزوناً أيضاً حيث تدخل ذرات في التفاعل وتخرج ذرتان منه.







