تعريف قانون ستوكس يمكن تعريف قانون ستوكس بأنّه معادلة رياضية تعبر عن سرعات الاستقرار لأجسام كروية صغيرة في الوسط السائل، وقد تمت صياغة هذا القانون عام 1851م من قبل العالم البريطاني جورج ستوكس، وهو يعبر عن القوة المؤثرة في جسم معين أثناء سقوطه في عمود سائل تحت تأثير الجاذبية الأرضية، فعندما تتحرك الأجسام الكروية الصغيرة في وسط لزج، تنتج قوة معيقة معاكسة لحركة الجسم، والتي تزيد بزيادة سرعة الجسم، وهي تعتمد حسب قانون ستوكس على لزوجة الوسط، ونصف قطر الجسم، وسرعته. صيغة قانون ستوكس يربط قانون ستوكس
ما هو المد والجزر المد والجزر هو حركة الأمواج صعوداً وهبوطاً بشكل متكرر يوميّاً، بسبب تفاعلات الجاذبيّة بين كلٍّ من الأرض ، الشمس والقمر، حيث يحدث عادةً في المناطق الضحلة القريبة من الشاطئ. آليّة حدوث المد والجزر تُعد قوة الجذب المُسببة للمد والجزر القادمة من القمر ذات تأثير أكبر من قوة جذب الشمس بسبب قُرب القمر للأرض مقارنةً بها، حيث تعمل قوّة الجاذبية على انتفاخ البحر للأعلى مؤدياً لارتفاع منسوبه، في كل من المنطقتين الأقرب والأبعد عن القمر، ومع دوران الأرض يبقى ارتفاع المياه في المناطق
دورة الخلية تمر الخلية الحيوية في أطوار عديدة من دورة حياتها الكلية التي تتخللها مرحلتا "الانقسام والانحناء" مع وجود مرحلتين انتقاليتين أيضاً، وبالتفصيل أكثر في هذه المراحل نذكر كل مرحلة على النحو الآتي: تطرأ تغيرات أيضية على الخلية من أجل تحضيرها لمرحلة الانقسام لتصل إلى مرحلة معينة تُجبر الخلية للانتقال إلى المرحلى التالية. مرحلة تصنيع الحامض النووي منقوص الأكسجين، فيتم تصنيع الحمض النووي المسؤول عن الصفات الوراثية، وكل كروموسوم يتألف من ثنائي كروماتيدين متطابقين ملتصقين. تعمل التغييرات
التيار المتردد التيار المتردد هو تيار كهربائي متغير الشدة والاتجاه يتم توليده في المولد الكهربائي المتردد، ويتصف هذا التيار بأنّه يعكس اتجاهه ويتذبذب بين 50 إلى 60 مرة في الثانية، ويُعرف بأنّه التيار الكهربائي الذي تتغير شدته من الصفر إلى أقصى درجة ثمّ تهبط إلى الصفر خلال نصف دورة، ويعكس اتجاهه مرة أخرى وتزداد شدته من الصفر إلى أقصى درجة وهكذا في كل دورة. يطلع على عدد الذبذبات الكاملة التي يحدثها التيار الكهربائي المتردد في الثانية الواحدة وتساوي عدد دورات الملف في الثانية الواحدة هو تردد
الماء تكسو المياه مساحات شاسعة من الكرة الأرضية على شكل مسطحات مائية وجداول وبحيرات وبحار ومحيطات بنسبة تصل إلى 71% من إجمالي مساحة الكرة الأرضية، وتأتي إلى الأرض على هيئة أمطار، ويحظى بأهمية بالغة كونه مكوناً رئيسياً للسوائل في كافة أجسام الكائنات الحية. درجة حرارة الماء يتخّذ الماء درجة حرارة قياسية للتكوين تصل إلى 285.83- KJ/mol، أما حرارتها النوعية فتصل إلى 0.0575.37 ± J/mol.k,، وتتفاوت درجات حرارة الماء وفقاً للحالة التي يكون عليها، فمثلاً في حالة السيولة تصل درجة الحرارة نحو 25 س، وبضغط
درجة انصهار الماء النقي يمكن تعريف درجة الانصهار بأنها الدرجة الثابتة التي تتحول فيها المادة النقية البلورية من حالتها الصلبة إلى الحالة السائلة بتأثير الحرارة؛ فعند التأثير بالحرارة على مادة صلبة ترتفع درجة حرارتها حتى تصل إلى درجة الانصهار.تعتبر درجة الانصهار خاصية تعبر عن نقاء المواد البلورية، إذ تعتمد درجة انصهار الماء بشكل مباشر على عاملين هما: قيمة الضغط المؤثر عليه، ونسبة الشوائب فيه. فكلما احتوى الماء على شوائب فإن درجة انصهاره تقل عن درجة الانصهار المتوقعة له، حيث تبلغ درجة انصهار
درجة انصهار الزجاج يعبّر مفهوم درجة انصهار المادّة عن درجة الحرارة التي تتغيّر عندها حالة المادّة من الحالة الصلبة إلى الحالة السائلة، وتختلف قيمة درجة الحرارة التي تنصهر عندها المادّة الصلبة النقيّة الواقعة ضمن ظروف الضغط الجويّ المعياريّة، لذلك تعتبر نقطة الانصهار خاصّية فريدة للمادّة ويمكن استخدامها للتعريف عنها، أمّا درجة الانصهار الخاصّة بالزجاج فتبلغ 2600-2900 فهرنهايت، أو 1425-1600 درجة مئويّة وتعتمد درجة الانصهار على مكوّنات الخليط. الزجاج يعتبر الزجاج أحد المواد الصلبة الغير عضويّة،
درجة انصهار الجليد تُشير درجة انصهار الجليد إلى درجة الحرارة التي يتحوّل عندها الجليد إلى ماء، وهي تُساوي درجة تجمد الماء، والتي تُشير إلى درجة الحرارة التي يتحوّل فيها الماء من الحالة السائلة الى الصلبة، فدرجة انصهار جليد الماء وتجمّد الماء تُساوي 0 درجة مئوية. تُسمى درجة الحرارة التي يحتاجها 1 كغم من الجليد لينصهر عند مستوى الضغط الجوي العادي بالحرارة الكامنة للانصهار، وتُعادل 3.34* 105 جول/ كلغم من الثلج عند درجة 0 مئوية، ويجدر الذكر أنّه عند انصهار الجليد فإنّه بذلك يتغيّر من الناحية
خواص صخور المكمن توجد مجموعة من الخصائص المتعلقة بصخور المكمن المهمّة بالنسبة لمهندسي المكامن وخبراء الجيولوجيا مُقارنةً ببعض الخصائص الأخرى، وتشمل تلك الخصائص: المساميّة، والانضغاطيّة، والنفاذيّة، وفيما يأتي توضيح لكلٍّ منها: المسامية تُمثّل المساميّة (بالإنجليزية: Porosity) نسبة حجم الفراغ في وسط مساميّ إلى الحجم الكُليّ لذلك الوسط، حيث يتمّ التعبير عنها عادةً كنسبة مئوية مُمثلّة بالرمز الإغريقي فاي (Φ)، وتُصنّف أشكال مساحات المسام حسب التصنيف الموروفولوجي إلى 3 أنواع وهي الآتية: السلسلي:
الماء في حياتنا يُغطّي الماء سبعين بالمئة من سطح الكرة الأرضية ، كما يُشكل تسعين بالمئة من وزن الكائن الحي، وله أهميّة كبيرة في حياة الكائنات الحية، كما يرطّب الجسم، ويجعله مرناً ليؤدّي وظائفه بسهولة، ويفرز الماء مواد مائعة تساعد على امتصاص الطعام المهضوم، لذلك يلزم جسم الإنسان يومياً من لترين إلى ثلاث لترات من الماء. أشكال الماء عندما تتحد ذرتان من الهيدروجين مع ذرة واحدة من الأكسجين ينتج لدينا مركب يطلق عليه "الماء"، وهو سائلٌ عديمُ الطعم، وعديمُ الرائحة، وعديمُ اللون مائلاً إلى الزرقة
خصائص اللافلزات تتحلى اللافلزات بالكثير من الخصائص التي تختلف تماماً عن خصائص الفلزات ومنها: لها درجة غليان ودرجة انصهار منخفضة. ضعيفة التوصيل الحراري. ضعيفة التوصيل الكهربائي. تمتلك طاقة تأيّن عالية جداً تساعدها في جذب الإلكترونات إليها. تتمتع ببريق معدني قليل جداً يكاد يكون معدوماً. تعتبر اللافلزات الصلبة هشّة جداً لايمكن طرقها وتشكيلها. تتحد مع الأكسجين مكوّنةً أكاسيد حمضيّة. اللافلزات هي عناصر كيميائيّة غير معدنيّة، لاتتواجد بكثرة في الطبيعة مثل الفلزات، لكنها تعد ضروريّة جداً لنمو
خواص الكحولات كباقي المواد الأخرى توجد للكحولات العديد من الخصائص التي تنفرد بها أهمها: درجة الغليان ترتفع درجة غليان الكحولات بارتفاع عدد ذرات الكربون الموجودة في تركيبها، كما تمتلك الكحولات درجة غليان أعلى بكثير من غيرها من المركبات الأخرى مثل مجموعة الألكانات. روابط الهيدروجين ترتبط ذرات الهيدروجين الموجبة مع ذرات الأكسجين السالبة مكونةً بذلك ذرات قوية جداً تحتاج إلى طاقة هائلة لكسرها، يعود السبب في ذلك لارتفاع درجة غليان الكحولات. الذائبية في الماء تقل نسبة ذائبية الكحول بزياده عدد زرات
خواص الإنزيمات تمتلك الإنزيمات عدداً من الخواص أهمها: تتأثر الإنزيمات بدرجات الحرارة، حيث ثؤثر على نشاط الإنزيم وعمله. يُظهر الإنزيم أعلى معدّل نشاط له في درجة حموضة مابين (4-9) يُؤثّر تركيز الإنزيم على سير التفاعل ومستوى حدوثة. تزيد الإنزيمات من سرعة حدوث التفاعلات الكيميائيّة . تقوم الإنزيمات بخفض طاقة تنشيط التفاعل، من خلال الارتباط بجزيئات المواد المتفاعلة، مما يؤدي لتكسير الروابط مابينها بسهولة. ما هي الإنزيمات تزدحم أجسام الكائنات الحية بالكثير من العمليات الحيوية والتفاعلات الكيميائية،
خواص الألماس يمتلك حجر الألماس الكثير من الخواص أهمّها: يحتل المرتبة العاشرة في لائحة أصلب المعادن وأقساها المكوّنة من عشرة معادن، والتي تسمى بمقياس موس. قدرة الألماس العالية على تشتيت الضوء بشكل رائع، وهذا ما يمنحه تألّقه المعروف، إذ ينكسر الضوء الأبيض عند مروره عبر حجر الألماس مظهراً ألوان الطيف السبعة. يعد الألماس مقاوماً حرارياً جيّداً. الألماس الألماس هو من أعلى الأحجارالكريمة ثمناً وقيمةً، نظراً لمظهره الجميل المتألّق وصلابته. يعد عنصر الكربون المكوّن الرئيسي له، ويعود تكوّن الألماس لقبل
خواص الأحجار الكريمة تتعدد خصائص الأحجار الكريمة والصفات المرتبطة بأهميتها، لكن هناك ست خصائص لا بد من اخذها بعين الاعتبار عند دراسة موضوع الأحجار الكريمة، وفيما يلي أبرز تلك الخواص مرتبة من حيث الأهمية: الجذب البصري يشتمل على عدة عوامل مهمة، منها نذكر ما يلي: اللون: يعتبر اللون من الخصائص المهمة جداً فيما يتعلق بالأحجار الكريمة مثل الروبي والياقوت والزمرد التي تملك ألواناً جذابة مع خاصية الشفافية التي تمتاز بها، بينما الأحجار الكريمة التالية (المرجان و اللازورد والعقيق) تملك ألواناً جذابة دون
خصائص محركات التيار المستمر تمتلك محركات التيار المستمر العديد من الخصائص التي تختلف من نوع إلى آخر ومنها:- يتناسب عزم الدوران تناسباً طرديا مع التيار المار بالمُنتج، أي أنه بزيادة التيار الكهربائي في الجزء المتحرك من المحرك فإنه يزداد عزم دورانه. تعتمد سرعة مُنتج الحركة على الحِمل المطبق عليه عند ثبات فرق الجهد الكهربائي. عند ثبات الحِمل تعمد سرعة منُتج الحركة على فرق الجهد الكهربائي. يتسبب وجود مجالين كهربائين مختلفين بالاتجاه توليد ممانعة تسمى بالممانعة الداخلية للمحرك بالإضافة لوجود نوع
خصائص غاز الهيدروجين كأي عنصرٍ كيميائي يمتلك غاز الهيدروجين العديد من الخصائص الفيزيائية والكيميائية ومنها: يتواجد في الحالة الغازية في الحالة الطبيعية وتحت الضغط الجوّي الطبيعي، بالإمكان تحويله لسائل ليتم استخدامه كوقود عن طريق تطبيق ضغط كبير عليه، أو عن طريق القيام بتبريده. لا يمتلك لوناً ولا طعماً ولا رائحة، ويضاف له بعض الروائح عند استخدامه كوقود ليتمكّن المستخدم من ملاحظة أي انبعاثٍ له. يعد مادةً غير سامّة. يمتلك درجة غليان منخفضة بسبب ضعف قوى التجاذب مابين جزيئات، تتراوح قيمتها بين
خصائص عنصر الكالسيوم يمتلك عنصر الكالسيوم العديد من الخصائص الفيزيائية والكيميائية الخاصّة به وهي: يمتلك عدداً ذريّاً يساوي 20، وهو عدد الإلكترونات التي يملكها في ذرّته. يمتلك درجة غليان تساوي 1484 درجةً مئويّة، ودرجة انصهار تساوي 842 درجةً مئويّة. يمتلك عنصر الكالسيوم لوناً أبيض مائل للفضّي. يمتاز الكالسيوم بموصليّته للكهرباء . يتفاعل مع الهواء بدرجة سريعة مكوّناً أُكسيداً بلونٍ رمادي. الكالسيوم هو عنصرٌ من المعادن القلوية ذو الرمز (Ca)، وهو أكثر المعادن وجوداً في جسم الإنسان، وخصوصاً في
خصائص حجر البازلت يمتلك حجر البازلت العديد من الخصائص الفيزيائية ومنها: يمتاز البازلت بلونه القاتم المتدرج تحت ألوان الأسود والرمادي. يعد حجر البازلت من الصخور الصلبة، إذ تبلغ صلابتة 6 على مقياس Mohs. يعد من الصخور النحاسيّة كثيفة الحبيبات. يمتلك كثافة عالية جداً، وهذا يرجع لاحتوائه على 50% من السليكا. تتشكل اللافا المكوّنة للبازلت على درجات حرارة عالية جداً تبلغ قيمتها 1200 درجةً مئوية. يتكوّن البازلت من معادن ذات مقاومة قليلة للعوامل الجوّية، مما يؤدي لتففككها بسرعة مقارنةً مع الصخور
الهواء الهواء عبارة عن مجموعة من الغازات التي تشكل الغلاف الجوي للأرض، حيث يتكون بشكل أساسي من 78% من النيتروجين، و21% من الأكسجين، ومن بعض الغازات النادرة بنسب قليلة مثل: ثاني أكسيد الكربون، وغاز النيون، والهيليوم، والآرغون، والزينون، ومن بخار الماء، ويحيط الهواء بالكرة الأرضية ويصل إلى ارتفاع 880كم، وهو المسؤول عن حياة الإنسان، والحيوان، والنبات على الأرض. أهمية الهواء يلعب دور أساسي في عملية التمثيل الضوئي للنباتات. يساهم في قيام بعض العمليات الكيميائية مثل: تصنيع الخل والصدأ. يساعد على
خصائص النيتروجين السائل يتمتع النيتروجين بعدد من الخصائص أهمها: درجة غليان النيتروجين السائل تبلغ -195.8 درجةً مئوية. يعتبر غاز النيتروجين مادّةٌ غير سامّة. يعد غاز النيتروجين غازاً خاملاً. يعد النيروجين مادةً غير قابلةً للاشتعال. لايمتلك لون أو رائحة. يعتبر مادةً باردةً جداً، حيث تسبب الصقيع عند ملامستها لجلد الإنسان. النيتروجين السائل النيتروجين السائل هو النيتروجين المبرد تحت درجة حرارة منخفضةً جداً تكفي لحتويله للحالة السائلة، وتبلغ قيمتها 200 درجةً مئويةً تحت الصفر، ويرمز له بالرمز (LN2).
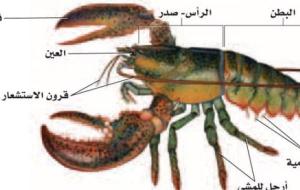
المفصليّات Phylum Arthropoda، تعتبر شعبة المفصليّات واحدة من شُعب المملكة الحيوانيّة الهامة، وينتمي إليها أكثر من 75% من المملكة الحيوانية الفقاريّة، وهي تلك الحيوانات التي تمتلك مفاصلاً في الأرجل، وكما تمتلك دروعاً شبيهة بالهياكل الخارجيّة الصلبة، ومنها القرون أو الكيتين، والصدفات. يتألف جسم الحيوان المفصليّ من عدة مقاطع، وتمتلك بعض هذه الحيوانات في كل مقطع من مقاطع جسمها زوجاً من السيقان التي تستخدمها للتعايش مع البيئة المحيطة بها كالمشي والسباحة، ومنها ما يمتلك ثلاثة أزواج من السيقان.
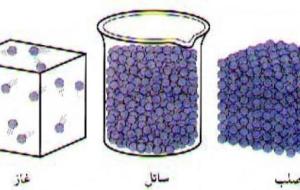
المادة تعرف المادة على أنها كل شيء له حجم وكتلة، ويشغل حيّزاً في الفراغ، وتعتبر المادة جزءاً من الكون؛ حيث إنّها تشكّل تقريباً 27% منه، كما وتمتلك العديد من الخواص والصفات التي تمكّننا من ترتيب المواد ومقارنتها حسب هذه الخصائص؛ فجميع المواد على سطح الكرة الأرضية تختلف في خصائصها وصفاتها، وذلك بالاعتماد على خواص المادة الرئيسية، كالكتلة والحجم والكثافة، وهنا سوف نتناول خواص المادة وسوف نتطرّق إلى حالاتها. خصائص المادة للمادة خصائص كثيرة ومتنوعة نذكر منها ما يلي: الخصائص الكهربائية، (السماحية،
الماء الماء هو مركّب كيميائيّ بسيط، ويتكوّن بصورة أساسيّة من الأكسجين والهيدروجين ؛ لذا يُطلق عليه اسم أول أكسيد الهيدروجين، وعلى الرغم من بساطته لا يمكن التغاضي عن أهمية الماء الكبيرة للحياة فهو يغطي أكثر من 70% من سطح الارض ويشكل أكثر من 60% من أجساد النباتات والحيوانات؛ لذا يقال أن الماء هو سر الحياة. ويوجد الماء على سطح الأرض بثلاث حالات، وهي: الصّلبة، والسّائلة، والغازيّة، وتعتمدُ حالته على درجة الحرارة، كما توجد له خصائص تميّزه عن غيره من المركّبات سيرد ذكرها في هذا المقال. حالات الماء