معادلة تفاعل كربونات الكالسيوم مع حمض الهيدروكلوريك
معادلة تفاعل كربونات الكالسيوم مع حمض الهيدروكلوريك
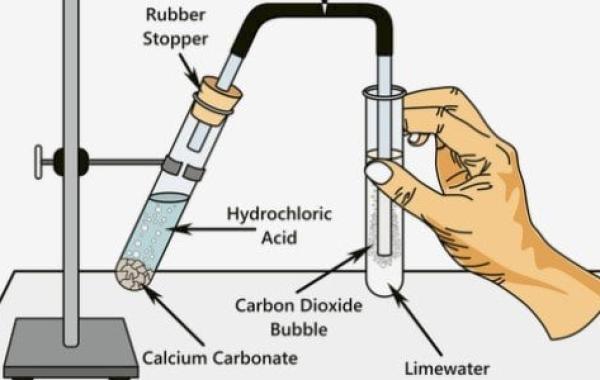
تعرف كربونات الكالسيوم (CaCO 3 ) على أنها مركب كربوني معدني ؛ متواجد طبيعيًا في الأحجار الجيرية والرخام، وهذا المركب غير قابل للذوبان في الماء، أي يمكن أن يتواجد على شكل رواسب مائية، وتقبل كربونات الكالسيوم التفاعل مع حمض الهيدروكلوريك (HCl) لإنتاج ثاني أكسيد الكربون (CO2)، وكلوريد الكالسيوم (CaCl2)، والماء (H2O)، تبعًا للمعادلة التالية:
كربونات الكالسيوم حمض الهيدروكلوريك كلوريد الكالسيوم ماء ثاني أكسيد الكربون
وتمثل بالرموز؛ CaCO3(s) 2HCl(aq) CaCl2(s) H2O(l) CO2(g)
وتدل الرموز الصغيرة المتواجدة في الأقواس على حالة المركبات الفيزيائية كما يلي:
- يدل الرمز (s)؛ على الحالة الصلبة (Solid).
- يدل الرمز (aq)؛ على المحلول أو المركب المائي (Aqueous).
- يدل الرمز (g)؛ على الحالة الغازية (Gas).
- يدل الرمز (l)؛ على الحالة السائلة (Liquid).
إذًا؛ تتفاعل كربونات الكالسيوم في الحالة الصلبة مع حمض الهيدروكلوريك لإنتاج الماء في الحالة السائلة، وثاني أكسيد الكربون كغاز، وكلوريد الكالسيوم كمادة صلبة قابلة للذوبان في الماء وعديمة اللون، ويلاحظ في التفاعل ارتفاع فقاعات الغاز إلى أعلى المحلول بسبب خروج غاز ثاني أكسيد الكربون.
أهمية كربونات الكالسيوم
تتمثل أهمية كربونات الكالسيوم في تعدد استخداماته ووفرته على النحو التالي:
- تكون كربونات الكالسيوم ما نسبته 4٪ من قشرة الأرض، ويوجد هذا المركب بعدة أشكال طبيعية في كل من؛ الطباشير، والحجر الجيري، والرخام.
- تستخدم في صنع طباشير الألواح المدرسية.
- يزود هذا المركب الكائنات الحية بالعناصر التي تحتاجها لنمو أصدافها وهياكلها العظمية وقشور بيوضها.
- يساعد تفاعل كربونات الكالسيوم مع الحمض العلماء أو الجيولوجيين في اختبار تحديد كربونات الكالسيوم، كما أن هذا التفاعل هو السبب في تكوين الكهوف والهوابط والصواعد.
- تستخدم في صناعات الورق والبلاستيك والدهانات، فقد يمثل ما نسبته 30% من مكونات الدهان في بعض الأحيان.
- تستخدم كمكمل غذائي فعال للكالسيوم، أو مضاد للحموضة، كما تستخدم كمادة رابطة للفوسفات، وقد تستخدم كذلك كمادة أساسية للأقراص الطبية.
- تستخدم في صناعة مسحوق الخبز، ومعجون الأسنان، وخلطات الحلوى الجافة، والعجين.
- تضاف إلى علف الحيوانات.
- تستخدم في عملية معالجة المياه والنفايات.
- تستخدم في صنع مواد البناء والإنشاءات مثل؛ الرخام، والإسمنت، والملاط المستخدم في ربط الطوب.
- تستخدم نواتج تحلل كربونات الكالسيوم في صناعة الفولاذ، والزجاج، والورق.
- تُستخدم في البيئات الصناعية لمعادلة الظروف الحمضية في كل من التربة والمياه.
خصائص ومركبات الكالسيوم
خصائص الكالسيوم
ينتمي عنصر الكالسيوم لمجموعة الفلزات القلوية الترابية، لذلك يوجد في المجموعة الثانية من الجدول الدوري، وهو من أكثر المعادن وفرةً في جسم الإنسان وخامس أكثر العناصر وفرةً في قشرة الأرض، و من خصائص عنصر الكالسيوم ما يلي :
- العدد الذري: 20.
- الوزن الذري: 40.078.
- درجة انصهار الكالسيوم: 842 سليسيوس.
- درجة غليان الكالسيوم: 1,484 سليسيوس.
- حالة أو عدد التأكسد للكالسيوم: ( 2).
مركبات الكالسيوم
لا يتواجد عنصر الكالسيوم حرًا في الطبيعة، بل يتواجد ضمن مركبات كيميائية أهمها ما يلي:
- كربونات الكالسيوم CaCO3.
- أكسيد الكالسيوم CaO، المعروف بالجير؛ وهي مادة صلبة بيضاء أو رمادية اللون ناتجة عن طريق تحميص كربونات الكالسيوم.
- هيدروكسيد الكالسيوم أو الجير المطفأ Ca(OH)2.
- كلوريد الكالسيوم CaCl2؛ وهو مادة صلبة عديمة اللون أو بيضاء اللون.
- كبريتات الكالسيوم CaSO4.
- فوسفات الكالسيوم Ca3(PO4)2.
تحذيرات للتعامل داخل المختبر
توجد عدة نصائح وتحذيرات للتعامل مع المواد الكيميائية داخل المختبر ومنها:
- حماية العينين بارتداء النظارات الواقية.
- حماية الجلد بارتداء القفازات.
- معرفة مواقع حمامات السلامة المختبرية، وأماكن غسيل العيون، وطفايات الحريق، ومخرج الطوارئ.
- إغلاق حاويات المواد الكيميائية، وعدم صب المواد الكيميائية في المصارف الصحية.
- تجنب شم وتذوق ولمس أي من المواد الكيميائية.
- استخدام الأدوات للغرض المخصص لها فقط.
- يمنع الركض أو اللهو داخل المختبر.
- عدم التعامل مع أي مادة كيميائية دون وجود مشرف المختبر.
- عدم تخزين أو تناول الطعام والشراب داخل المختبر.
يعرف مركب كربونات الكالسيوم (CaCO3) على أنه مركب كربوني معدني، يمكنه التفاعل مع حمض الهيدروكلوريك، وينتج عن التفاعل كل من؛ كلوريد الكالسيوم، والماء، وثاني أكسيد الكربون الذي يظهر على شكل فقاعات خلال التفاعل، ويمكن استخدام كربونات الكالسيوم الناتجة عن التفاعل في العديد من التطبيقات الحياتية، كصناعة الطباشير، والبلاستيك، والأوراق، وغيرها العديد.