العدد الذري والعدد الكتلي
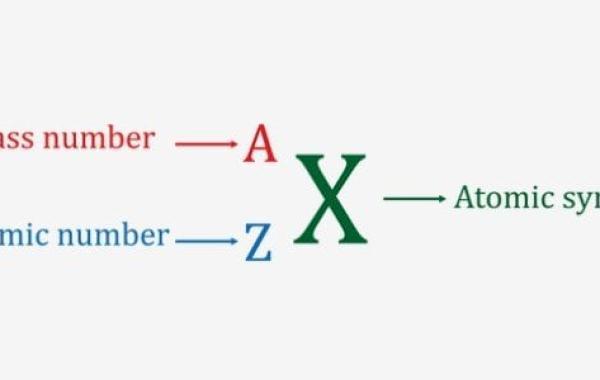
تعريف العدد الذري
يُعرف العدد الذري على أنّه عدد البروتونات في الذرة، ويُشار له بالرمز (Z)، إذ يمكن تحديد نوع العنصر وخصائصه من خلاله.
وما تجدر الإشارة إليه أنّ الجدول الدوري الحديث تم ترتيب العناصر فيه بناءً على ازدياد العدد الذري، والذي اكتشفه العالم هنري موزلي، إذ يوضع العدد الذري أعلى العنصر في الجدول الدوري ، أما عند التعبير عن العنصر فإنه يوضع على يسار العنصر ويُعبر عنه برقم صغير أسفل العنصر.
تعريف العدد الكتلي
يُعرف العدد الكتلي بأنّه مجموع عدد البروتونات والنيوترونات وفقاً للمعادلة الرياضيّة الآتيّة:
العدد الكتلي = عدد البروتونات عدد النيوترونات
ويُشار له بالرمز (A)، إ ذ يوضع العدد الكتلي في الجدول الدوري أسفل العنصر، أما عند التعبير عن العنصر فإن العدد الكتلي يوضع على يسار العنصر بحيث يعبّر عنه برقم صغير الحجم أعلى العنصر.
ويجدر بالذكر أن كتلة الإلكترونات لا تدخل في حساب العدد الكتلي، وذلك لأن كتلتها صغير جداً، وأصغر ب 1,800 مرة تقريباً من كتلة البروتون، كما أنّ العدد الكتلي لأي ذرة يساوي الكتلة الذرية مقرباً إلى أقرب عدد صحيح، بالإضافة إلى أنّ النظائر المُختلفة للعنصر نفسه يكون لها أعداد كتليّة مختلفة ، وذلك لأنها تحوي أعداداً مختلفة من النيوترونات.
العلاقة بين العدد الذري للعنصر وسلوكه الكيميائي
يمكن تحديد الخصائص الكيميائيّة للعنصر من خلال معرفة عدده الذري بالجدول الدوري، وذلك لأن عدد البروتونات يساوي عدد الإلكترونات في الذرة المتعادلة.
ويمكن من خلال معرفة عدد الإلكترونات تحديد التوزيع الإلكتروني للعنصر، ومعرفة طبيعة إلكترونات التكافؤ في المدار الأخير؛ حيث إن طبيعة هذه الإلكترونات تحدد مدى قدرة الذرة على مشاركة إلكتروناتها، وتكوين روابط كيميائية خلال التفاعلات الكيميائية.
أمثلة على حساب العدد الذري والعدد الكتلي
يتم استخدام العدد الذري والعدد الكتلي من أجل تكوين صورة كاملة عن الذرة والعناصر، من حيث الصفات والخصائص، ومدى قوة تمسك النواة بالذرات، ومعرفة عدد البروتونات، والإلكترونات، والنيوترونات لكل عنصر، وفيما يأتي أمثلة توضحية :
- مثال (1): ذرة عددها الذري 9، وعددها الكتلي 19 فما هو عدد البروتونات، وعدد الإلكترونات، وعدد النيوترونات فيها؟
- الحل:
- عدد البروتونات هو 9، وذلك لأن عدد البروتونات يساوي دائما العدد الذري.
- عدد الإلكترونات هو 9، وذلك لأن عدد البروتونات يساوي عدد الإلكترونات في الذرة المتعادلة.
- عدد النيوترونات هو 10، وذلك لأن عدد النيوترونات يمكن الحصول عليه من خلال طرح العدد الذري من العدد الكتلي، أيّ أنّ (عدد البرتونات عدد النيوترونات) - (عدد البروتونات) = عدد النيوترونات.
- الحل:
- مثال (2): ما هو عدد النيوترونات في ذرة الكلور (Cl) التي عددها الذري 17، وعددها الكتلي 35؟
- الحل:بما أنّ العدد الذري يساوي عدد البروتونات، والعدد الكتلي = عدد البروتونات عدد النيوتروناتفإن 35 = 17 عدد النيوتروناتوبالتالي فإن عدد النيوترونات = 35 - 17= 18 نيوتروناً.
- مثال (3): ذرة الصوديوم ، العدد الذري لها هو 11، ما هو عدد البروتونات والإلكترونات؟
- الحل: يُلحظ أنّ العدد الذري= عدد البروتونات= عدد الإلكترونات في الذرة المتعادلة، وبالتالي فإن عدد البروتونات يساوي 11، وعدد الإلكترونات يساوي 11 أيضاً.
- مثال (4): ما هو عدد البروتونات، والنيوترونات، والإلكترونات في الذرة المتعادلة لعنصري البورون (B5) والزئبق (Hg80)؟
- الحل:
- العدد الذري في ذرة البورون=5، إذاً عدد البروتونات=5، وعدد الإلكترونات=5، وعدد النيوترونات=5.
- العدد الذري في ذرة الزئبق =80، إذاً عدد البروتونات=80، عدد الإلكترونات=80، وعدد النيوترونات 119.
- الحل:
العدد الذري والكتلي لأشهر العناصر الكيميائيّة
يبين الجدول الآتي الأعداد الذرية، والكتلية لأشهر العناصر المستخدمة مرتبة من المجموعة الأولى إلى المجموعة الثامنة:
| رقم المجموعة | العنصر | العدد الذري | العدد الكتلي | العنصر | العدد الذري | العدد الكتلي | العنصر | العدد الذري | العدد الكتلي |
| 1 | الهيدروجين (H) | 1 | 1 | الليثيوم (Li) | 3 | 6 | الصوديوم (Na) | 11 | 23 |
| 2 | البريليوم (Be) | 4 | 10 | المغنيسيوم (Mg) | 12 | 24 | الكالسيوم (Ca) | 20 | 40 |
| 3 | البورون (B) | 5 | 11 | الألمنيوم (Al) | 13 | 27 | الجاليوم (Ga) | 31 | 70 |
| 4 | الكربون (C) | 6 | 12 | السيليكون (Si) | 14 | 28 | الرصاص (Pb) | 82 | 207 |
| 5 | النيتروجين (N) | 7 | 14 | الفسفور (P) | 15 | 31 | الزرنيخ (AS) | 33 | 75 |
| 6 | الأكسجين (O) | 8 | 16 | الكبريت (S) | 16 | 32 | البولونيوم (Po) | 84 | 206 |
| 7 | الفلور (F) | 9 | 19 | الكلور (Cl) | 17 | 35.5 | البروم (Br) | 35 | 80 |
| 8 | الهيليوم (He) | 2 | 4 | النيون (Ne) | 10 | 20 | الأرغون (Ar) | 18 | 40 |