مبدأ أوفباو للتوزيع الإلكتروني
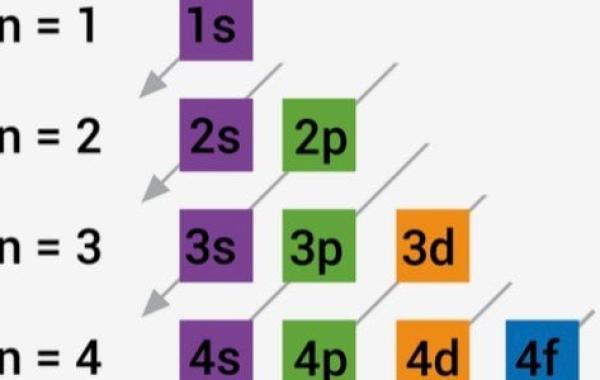
ما هو مبدأ أوفباو للتوزيع الإلكتروني؟
(بالإنجليزية: Aufbau Principle) هو مبدأ نظري في الكيمياء، يوضح توزيع الإلكترونات بحسب طاقتها في المدارات الذرية للذرة في حالتها المستقرة، ويكون عدد الإلكترونات الموزعة على مدارات الذرة مساوياً للعدد الذري للعنصر.
خصائص مبدأ أوفباو للتوزيع الإلكتروني
باتباع مبدأ أوفباو، يمكن التنبؤ بترتيب الإلكترونات في مدارات الذرة، ولهذا المبدأ خصائص تصف حالة توزيع الإلكترونات للذرات والأيونات كما يأتي:
- تحتل الإلكترونات المدارات الأقل طاقة أولاً.
- يتم تحديد الترتيب الذي تزداد به الطاقة المدارية باستخدام القاعدة (n l) حيث إنّ n هو عدد الكم الرئيسي.
- الترتيب الذي تمتلئ به المدارات بالإلكترونات (ابتداءً من 1s) هو: 1s ، 2s ، 2p ، 3s ، 3p ، 4d ، 4p ، 5s ، 4d ، 5p ، 6s ، 4f ، 5d ، 6p ، 7s ، 5f ، 6d ، 7p وهكذا.
استثناءات مبدأ أوفباو للتوزيع الإلكتروني
لا يمكن استخدام مبدأ أوفباو للتوزيع الإلكتروني في الحالات الآتية:
- الحالة الأولى
لا يمكن استخدام مبدأ أوفباو للتنبؤ بتوزيع الإلكترونات لبعض الذرات في حالتها المتأينة، لأنه لا يمكن التنبؤ من خلاله عن الإلكترونات التي يمكن إضافتها أو منحها عند تحول الذرة إلى أيون.
على سبيل المثال:
لتوزيع إلكترونات ذرة الحديد (Fe) Iron على أساس مبدأ أوفباو، علماً بأن العدد الذري للحديد = 26، فإن التوزيع على مبدأ أوفباو يكون كالآتي:
1s2 2s2 2p6 3s2 3p6 4s2 3d6
ومن تجارب الدراسات الطيفية والمغناطيسية وُجد أن إلكترونات الأيون Fe 2 لها التوزيع الحقيقي الآتي:
1s2 2s2 2p6 3s2 3p6 3d6
وليس كما يقترح مبدأ أوفباو
1s2 2s2 2p6 3s2 3p6 4s2 3d4
أي أن التأين يؤدي إلى فقدان إلكترونات 4s وليس إلكترونات 3d.
- الحالة الثانية:
في بعض الحالات، تحتوي المدارات نصف الممتلئة على تنافرات أقل بين إلكتروناتها والإلكترونات في المدارات الأخرى، مما يزيد من استقرار الذرة، ويؤدي ذلك إلى استقرار المدارات المحيطة بالنواة، وهو أمر مخالف لمبدأ أوفباو.
على سبيل المثال:
التوزيع الإلكتروني الحقيقي لذرة الكروم Chromium (Ar)، علماً بأن العدد الذري للكروم = 24، يكون كالآتي:
3d5 4s1
وليس كما يقترح مبدأ أوفباو
3d4 4s2
ويُعزى هذا الاستثناء إلى عدة عوامل مثل الاستقرار المتزايد الذي توفره المدارات نصف الممتلئة في ذرة الكروم.
- الحالة الثالثة:
في بعض الحالات، يشذ التوزيع الإلكتروني لبعض العناصر، فينتقل الإلكترون من مستوى طاقة إلى مستوى طاقة آخر، سعياً لملء المدار والوصول إلى المزيد من الاستقرار للعنصر.
على سبيل المثال:
لتوزيع إلكترونات ذرة النحاس Copper (Cu) على أساس مبدأ أوفباو، علماً بأن العدد الذري للنحاس = 24، فإن التوزيع الحقيقي يكون كالآتي:
1s2 2s2 2p6 3s2 3P6 4S1 3d10
وليس كما يقترح مبدأ أوفباو
1s2 2s2 2p6 3s2 3P6 4S2 3d9
والسبب هو انتقال إلكترون في ذرة النحاس من مدار المستوى 4s إلى المستوى الفرعي 3d.
تمارين على مبدأ أوفباو للتوزيع الإلكتروني
فيما يأتي بعض الأمثلة المتنوعة على طريقة التوزيع الإلكتروني باستخدام مبدأ أوفباو:
التوزيع الإلكتروني لذرة الصوديوم
التوزيع الإلكتروني لذرة الصوديوم (Sodium Na) على أساس مبدأ أوفباو، علماً بأن العدد الذري للصوديوم = 11، يكون كالآتي:
1s2 2s2 2p6 3s1
التوزيع الإلكتروني لذرة الجرمانیوم
التوزيع الإلكتروني لذرة الجرمانیوم ( Germanium Ge) على أساس مبدأ أوفباو، علماً بأن عدده الذري = 32، يكون كالآتي:
1S2 2S2 2P6 3S2 3P6 4S2 3d10 4P2
التوزيع الإلكتروني لذرة الكبريت
التوزيع الإلكتروني لذرة الكبريت ( Sulfur S) على أساس مبدأ أوفباو، علماً بأن عدده الذري = 16، يكون كالآتي:
1s2 2s2 2p6 3s2 3p4
التوزيع الإلكتروني لذرة السلینیوم
التوزيع الإلكتروني لذرة السلینیوم ( Selenium Se ) على أساس مبدأ أوفباو، علماً بأن عدده الذري = 34، يكون كالآتي:
1S2 2S2 2P6 3S2 3P 6 4S2 3d10 4P4
التوزيع الإلكتروني لذرة الخارصين أو الزنك
التوزيع الإلكتروني لذرة الخارصين أو الزنك (Zinc Zn) على أساس مبدأ أوفباو، علماً بأن عدده الذري = 30، يكون كالآتي:
1s2 2s2 2p6 3s2 3p6 4s2 3d10
التوزيع الإلكتروني لذرة الراديوم
التوزيع الإلكتروني لذرة الراديوم ( Radium Ra) على أساس مبدأ أوفباو، علماً بأن عدده الذري = 88، يكون كالآتي:
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 6s2 6p6 7s2