قانون الضغط
قانون باسكال للضغط
وضع باسكال قانونًا للضغط سمّي نسبةً له بقانون باسكال، وركّز فيه على ضغط المواد السائلة تحديدًا، ويُعرف بناءً على ذلك بمبدأ انتقال ضغط السوائل أيضًا، وينص القانون عمومًا على أنّ الضغط الخارجي المطبّق على سائلٍ ما سيتوزّع بصورة متكافئة على جميع أجزائه وبكلّ الاتجّاهات، شرط أن يكون السائل محصورًا، وبذلك تكون قيمة الضغط عند أي نقطة في السائل متساوية.
يُمكن التعبير عن قانون باسكال بالصيغة الرياضية الآتية:
القوة الخارجية = الضغط المنتقل عبر السائل × مساحة المقطع العرضي
ويُمكن تمثيله بالرموز كالآتي:
ق = ض × م
وبالإنجليزية:
F= PA
حيث أنّ:
- (ق) F: القوة الخارجية المطبّقة على السائل مقاسة بوحدة نيوتن.
- (ض) P: الضغط المنتقل عبر السائل مُقاسًا بوحدة (نيوتن/ م) ويُطلق عليها (باسكال).
- (م) A: مساحة المقطع العرضي للمنطقة المتأثّرة بالقوة مُقاسة بوحدة م.
يدخل قانون باسكال في العديد من التطبيقات في الحياة العملية، ومن ذلك ما يأتي:
- الرفع الهيدروليكي.
- الفرامل الهيدروليكية.
- المضخّات الهيدروليكية.
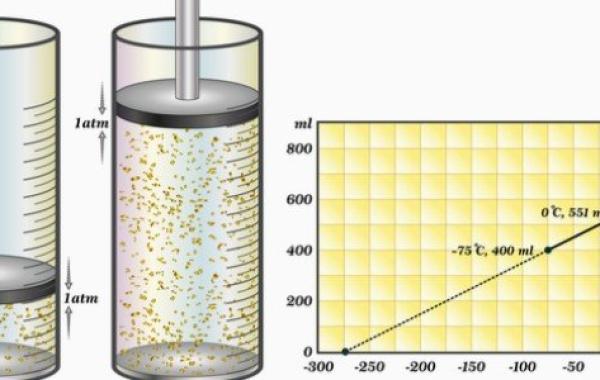
قانون بويل للضغط
يختص قانون بويل بالغازات، وسمّي بذلك نسبةً إلى العالم روبرت بويل، وينصّ القانون على أنّ العلاقة بين ضغط الغازات وأحجامها هي علاقة عكسية، إذ يقل حجم الغاز بزيادة ضغطه، ويكون ذلك شرط ثبات كل من:
- درجة حرارة الغاز.
- كمية الغاز أو بلغة أخرى كتلته.
تعبّر العلاقة (1/ح ∝ ض) عمّا سبق بالرموز، كما يمكن اشتقاق قاعدة رياضية من هذه العلاقة لتُصبح كما يأتي:
ثابت بويل = ضغط الغاز × حجم الغاز
ويُمكن تمثيله بالرموز كالآتي:
ث = ض × ح
وبالإنجليزية:
PV= k
حيث أن:
- (ض) P: ضغط الغاز بوحدة باسكال .
- (ح) V: حجم الغاز أو الحيّز الذي يُشغله بوحدة اللتر أو م.
- (ث) k: ثابت بويل.
يُمكن اشتقاق علاقة رياضيّة أخرى من العلاقة السابقة عند معرفة أنّ أي تغيير في حجم الغاز سيؤدي إلى تغيير العامل الآخر وهو ضغطه تِباعًا، كما أنّ أي تغيير في ضغطه سيؤدي إلى تغيير حجمه، وبالتالي فإنّ:
ضغط الغاز الابتدائي × حجم الغاز الابتدائي = ضغط الغاز النهائي × حجم الغاز النهائي
ويُمكن تمثيله بالرموز كالآتي:
ض1 × ح1 = ض2 × ح2
وبالإنجليزية:
P1V1 = P2V2
حيث أنّ:
- (ض1) P1: ضغط الغاز الابتدائي.
- (ح1) V1: حجم الغاز الابتدائي.
- (ض2) P2: ضغط الغاز النهائي.
- (ح2) V2: حجم الغاز النهائي.
قانون تشارلز للضغط
يدرس قانون تشارلز أحجام الغازات ويُشير إلى العلاقة الطردية بين حجم الغاز ودرجة حرارته المطلق، إذ كلّما زادت درجة الحرارة، تمدّد الغاز وزاد حجمه، ويُمكن التعبير عن ذلك بالرموز كما يأتي: ح ∝ د، كما يُمكن اشتقاق العلاقة الرياضية الآتية:
حجم الغاز الابتدائي / حجم الغاز النهائي = درجة حرارة الغاز الابتدائية / درجة حرارة الغاز النهائية
ويُمكن تمثيله بالرموز كالآتي:
ح1 × د2 = ح2 × د1
وبالإنجليزية:
V2/V1= T2/T1
أو
V1T2= V2T1
حيث أن:
- (ح1) V1: حجم الغاز الابتدائي.
- (ح2) V2: حجم الغاز النهائي.
- (د1) T1: درجة حرارة الغاز الابتدائية، بوحدة كلفن .
- (د2) T2: درجة حرارة الغاز النهائية، بوحدة كلفن.
يدخل قانون تشارلز في العديد من المشاهدات اليومية، ومن ذلك:
- المناطيد.
- انفجار علبة مزيل عرق عند رفع درجة حرارتها إلى أكثر من 50 مئوية.
- الخميرة المستخدمة في المخبوزات.
قانون أفوجادرو للضغط
ينصّ قانون أفوجادرو على أنّ أعداد جزيئات الغازات المثالية جميعها متساوية إذا كانت حجومها واحدة عند التأثير عليها بنفس درجة الحرارة والضغط، وبذلك يكون عدد جزيئات لتر واحد من غاز النيتروجين مكافئًا لعدد جزيئات لتر واحد من غاز الكلور مثلًا عند درجات الحرارة والضغط القياسيّين.
كما يمكن التعبير عن قانون أفوجادرو بالرموز الرياضية كما يأتي:
ثابت أفوجادرو = حجم الغاز/ عدد مولات الغاز
ويُمكن تمثيله بالرموز كالآتي:
ث= ح × ن
وبالإنجليزية:
V/n= k
حيث أنّ:
- (ح) V: الحجم، بوحدة اللتر أو م.
- (ن) n: عدد مولات الغاز.
- (ث) k: ثابت أفوجادرو، بوحدة مول.
يُستخدم قانون أفوجادو للغازات، ويمكن التعبير عنه رياضيًا كما يأتي:
الحجم الابتدائي للغاز/ عدد مولات الغاز الابتدائية = الحجم النهائي للغاز/ عدد المولات الغاز النهائية
ويُمكن تمثيله بالرموز كالآتي:
ح1/ ن1 = ح2/ ن2
وبالإنجليزية:
V1//n1 = V2/n2
حيث أنّ:
- (ح1) V1: الحجم الابتدائي للغاز.
- (ن1) n1: عدد مولات الغاز الابتدائية.
- (ح2) V2: الحجم النهائي للغاز.
- (ن2) n2: عدد مولات الغاز النهائية.
يعدّ مفهوم قانون أفوجادرو مفهومًا منفصلًا عن مفهوم الكتل المولية للغازات، ومن تطبيقاته العملية المهمّة عملية التنفس الرئوي ، ومن ذلك أيضًا ما يأتي:
- نفخ بالون، إذ إنّ إضافة عدد من جزيئات الغاز إلى البالون يتسبّب في زيادة حجمه.
- منفاخ إطارات الدراجات.
قانون جاي لوساك للضغط
يدرس قانون جاي لوساك العلاقة بين ضغط الغاز ودرجة حرارته المطلقة بوحدة كلفن عند ثبات حجمه، وينص على أنّ العلاقة بين الضغط ودرجة الحرارة هي علاقة طردية، ويمكن التعبير عن ذلك بالرموز الرياضية كما يأتي:
ضغط الغاز الابتدائي × درجة حرارة الغاز الابتدائية = ضغط الغاز النهائي × درجة حرارة الغاز النهائية
ويُمكن تمثيله بالرموز كالآتي:
ض1 × د2 = ض2 × د1
وبالإنجليزية:
P1T2= P2T1
حيث أنّ:
- (ض1) P1: ضغط الغاز الابتدائي، بوحدة باسكال.
- (د1) T1: درجة حرارة الغاز الابتدائية، بوحدة كلفن.
- (ض2) P2: ضغط الغاز النهائي، بوحدة باسكال.
- (د2) T2: درجة حرارة الغاز النهائية، بوحدة كلفن.
يُستخدم قانون جاي لوساك في الحياة العملية، كما يظهر في العديد من المشاهدات اليومية كما يأتي:
- الصمام العلوي المستخدم لتنظيم ضغط طناجر الضغط.
- انفجار إطارات السيارات في الأيام شديدة الحرارة.
- تشغيل طفايات الحريق لإخماد النيران في المباني.
- إطلاق الرصاص يجمع بين قانون جاي لوساك وقانون نيوتن الثالث.
أمثلة متنوعة على قوانين الضغط
تتنوّع القوانين المستخدمة في حسابات الضغط تبعًا للحالة والمعطيات المتاحة، وفيما يأتي بعض الأمثلة على ذلك:
مثال1: إذا كان حجم بالون منفوخ عند درجة حرارة 280 كلفن يكافئ 20 لتر، فماذا يحدث لحجم البالون إذا ارتفعت حرارته إلى 300 كلفن؟
الحل:
- يمكن استخدام قانون تشارلز ح2/ح1= ك2/ك1.
- يعوّض كل من القيم الآتية في رموز المعادلة: ح1= 20، ك1= 280،ك2=300.
- ينتج أنّ: ح2/20= 300/280، ومنه؛ ح2= 21.42.
- يكون الحجم النهائي هو 21.42 لترًا.
مثال2: إذا كان حجم حاوية غاز يعادل 2 لتر، وكان ضغط الغاز فيها 400 كيلو باسكال، ثمّ نُقلت نفس كمية الغاز مع ثبات درجة الحرارة إلى حاوية أخرى سعتها 4 لتر، فكم فماذا سيحدث لضغط الغاز؟
الحل:
- يقل ضغط الغاز بزيادة حجمه حسب قانون بويل.
- يمكن حساب الضغط النهائي باستخدام قانون بويل: ض1 × د1 = ض2 × د2.
- ينتج أنّ: 2×400= 4× ض 2 ، ومنه يكون ض 2 = 200.
- الضغط النهائي للغاز هو 200 كيلو باسكال.
مثال3: إذا كان ضغط غاز بحجم ثابت يكافئ 3 ضغط جوي (atm)، عند درجة حرارة 25 سيليسيوس، فكم يُصبح ضغطه إذا رُفعت حرارته إلى 70 سيليسيوس؟
الحل:
- يزداد الضغط بزيادة درجة الحرارة حسب قانون جاي لوساك: ض1 × ك2 = ض2 × ك1.
- يمكن حساب الضغط النهائي بتطبيق القانون بعد تحويل درجات الحرارة إلى كلفن، ك= س 273، فتصبح الحرارة الابتدائية 298، والنهائية 343.
- ينتج أنّ: 343 × 3= 298 × ض 2 ، ومنه فإن: ض 2 = 3.45 atm
مثال4: إذا كان الضغط المطبّق على سائل والناتج عن قوة المكبس يُكافئ 1500 باسكال، وكانت مساحة المقطع العرضي للمكبس 0.5 م، فما مقدار القوّة التي يؤثر بها المكبس على السائل؟
الحل:
- يُمكن استخدام قانون باسكال: ق= ض . م.
- يُعوَّض كل من ض= 1500، و م= 0.5.
- ينتج أنّ ق= 0.5×1500= 750.
- إذًا القوة الناتجة عن المكبس هي: 750 باسكال.
مثال5: إذا كان عدد المولات الابتدائي لغاز مثالي يكافئ 2 مول، وتضاعف حجم الغاز الموضوع في الحاوية فتغيّر من 1.5 لتر إلى 3 لتر بثبات كل من الضغط ودرجة الحرارة، كم ستصبح عدد مولاته النهائية؟
الحل:
- يمكن استخدام قانون أفوجادرو للضغط لحساب عدد المولات النهائي للغاز، ح1/ن1 = ح2/ن2
- ينتج من تعويض القيم في القانون: 1.5/2= 3/ن 2 ، ومنه يكون ن 2 = 2.25.
- إذن، عدد مولات الغاز النهائي = 2.25 مول.
تُوجد العديد من القوانين المستخدمة من أجل دراسة الضغط، ومنها: قانون باسكال للضغط، وقانون بويل، وقانون تشارلز، وقانون أفوجادرو، وقانون جاي لوساك، كما ويُوجد العديد من التطبيقات في الحياة العمليّة على كل قانون، ومنها: يجمع توضيح طريقة إطلاق الرصاص الناري بين قانوني جاي لو ساك للضغط، وقانون نيوتن الثالث.







