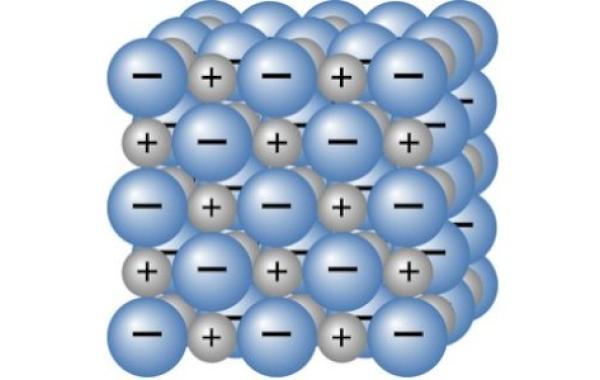
صيغ المركبات الأيونية
صيغ المركبات الأيونية أحادية الذرة
تكون الذرات عادةً مستقرة في تواجدها، أي أن شحنتها تكون متعادلة، وذلك لأن عدد البروتونات التي تحمل الشحنة الموجبة تتساوى في عددها مع عدد الإلكترونات التي تحمل الشحنة السالبة، وبالتالي تُلغي الشحنات قيمة بعضها بالمحصلة، وتكون محصلة الشحنة لتلك الذرة هي صفر.
عندما تفقد الذرات إحدى الإلكترونات أو تكتسب شحنات أخرى خلال التفاعلات فيما بينها، يؤدي ذلك إلى تغير العدد الكلي ما بين الإلكترونات والبروتونات وبالتالي تنتج شحنة للذرة، وعندها تسمى الذرة بالأيون (بالإنجليزية: ion).
تعرف الأيونات أحادية الذرات (بالإنجليزية: monatomic ions) بأنها الأيونات التي تتكون من عنصر واحد فقط مشحون بالشحنة السالبة أو الموجبة، وعند اكتساب هذا الأيون للشحنة الموجبة يسمى حينها كاتيون (بالإنجليزية: Cation)، أما عند اكتسابه للشحنة السالبة فيسمى أنيون (بالإنجليزية: Anion).
تُسمى المركبات الأيونية أحادية الذرة عبر إضافة المقطع (ide) في نهاية اسم العنصر، مما يجعل عملية التمييز بين الأيونات أسهل، ويمكن معرفة نوع شحنة المركبات الأيونية أحادية الذرات، وقيمتها من خلال معرفة رقم المجموعة التي يقع فيها ذلك العنصر داخل الجدول الدوري، وهي كالآتي:
- تحمل عناصر المجموعات (1/ 2/ 13) الشحنات ( 1/ 2/ 3) بالترتيب.
- تحمل عناصر المجموعات (15/ 16/ 17) الشحنات (-3/ -2/ -1) بالترتيب.
- تحمل عناصر المجموعة رقم 14 شحنة 4 أو -4؛ وذلك وفقًا لتفاعل العنصر.
- تحمل عناصر المجموعة رقم 18 الشحنة 0؛ لأنها متعادلة دائمًا.
فيما يأتي جدول يبين بعض الأمثلة على صيغ المركبات الأيونية أحادية الذرة:
| الذرة | الأيون | اسم المركب الأيوني أحادي الذرة |
| هيدروجين (H) | -H | Hydride |
| كلور (Cl) | -Cl | Chloride |
| بروم (Br) | -Br | Bromide |
| يود (I) | -I | Iodide |
| أكسجين (O) | O- | Oxide |
صيغ المركبات الأيونية ثنائية الذرة
تعرف المركبات الأيونية ثنائية الذرات (بالإنجليزية: diatomic compound) بأنها المركبات التي تتكون من ذرتين فقط من العناصر يكون أحدها مشحونًا بشحنة سالبة والآخر مشحونًا بشحنة موجبة، ويشترط بهذه العناصر أن يكون أحدها من الفلزات، والآخر غير فلز.
يمكن لهذه المركبات أن تتكون من ذرتين من عنصرين مختلفين، أو ذرتين لنفس العنصر، ويمكن للعديد من العناصر أن تتواجد في الطبيعة على شكل جزيء.
ويوجد أيضًا ما يعرف بالمركبات الثنائية (بالإنجليزية: Binary Ionic Compound) والتي تتكون من عنصرين مختلفين، ويمكن أن تكون مجموع الذرات في هذا المركب ذرتين أو أكثر.
وفيما يأتي بعض الأمثلة على صيغ لمركبات أيونية ثنائية الذرة:
| N 2 O 4 | رباعي أكسيد ثنائي النتروجين (dinitrogen tetroxide) |
| HCl | كلوريد الهيدروجين (hydrogen chloride) |
| CO | أول أكسيد الكربون (carbon monoxide) |
| CO 2 | ثاني أكسيد الكربون (carbon dioxide) |
| N 2 O 3 | ثلاثي أكسيد ثنائي النتروجين (dinitrogen trioxide) |
صيغ المركبات الأيونية عديدة الذرات
تعرف المركبات الأيونية عديدة الذرات (بالإنجليزية: Polyatomic ionic compounds) بأنها الأيونات التي تحتوي على أكثر من ذرة واحدة، وتعرضت هذه المركبات للتأين نتيجةً لفقدان أو اكتساب عدد من الإلكترونات مما أدى إلى اكتسابها للشحنة السالبة أو الموجبة.
تتصرف هذه المركبات عادةً وكأنها مركبات أيونية أحادية الذرات إلا أنها أكثر تعقيدًا منها وذلك لاحتوائها على ذرتين أو أكثر، ومن الأمثلة على المركبات الأيونية عديدة الذرات ما يأتي:
| (Hg 2 ) | الزئبق (Mercury) |
| (NH 4 ) | الأمونيوم (Ammonium) |
| -3(PO 4 ) | الفوسفات (Phosphate) |
| -(OH) | الهيدروكسيد (Hydroxide) |
| (NO 2 ) | النتريت (Nitrite) |
كيفية كتابة الصيغة الكيميائية للمركبات الأيونية
تختلف كتابة صيغ المركبات الكيميائية الأيونية اختلافًا طفيفًا وذلك وفقًا لمكونات المركب الأيوني كما يأتي:
تسمية المركبات الأيونية الأساسية
وهي المركبات التي تحتوي فقط على أيونين، ولا تحتوي على معادن انتقالية، ولتسميتها يجب اتباع الخطوات الآتية:
- أولًا، يجب معرفة الفلز واللافلز في المركب، حيث يمتار الفلز بشحنته الموجبة (الكاتيون) واللا فلز بشحنته السالبة (الأنيون)، ويمكن الاستعانة بالجدول الدوري لذلك، حيث تحتوي المجموعات من جهة اليسار والوسط على الفلزات، أم المجموعات من جهة اليمين فتحتوي على اللافلزات.
- كتابة الصيغة الكيميائية المُرادة بالرموز، مثل (NaCl) وبعدها يتم كتابة اسم الفلز أولًا، حيث دائمًا ما يتم كتابة اسم الكاتيون أولًا أي الفلز، وبعدها اسم اللافلز مُلحق بالمقطع (ide).
تسمية المركبات الأيونية التي تحتوي على معادن انتقالية
توجد المعادن الانتقالية في وسط الجدول الدوري، ولتسميتها يجب اتباع الخطوات الآتية:
- كتابة الصيغة الكيميائية المُرادة بالرموز أولًا.
- إيجاد قيمة شحنة الفلز وشحنة اللافلز، حيث إن شحنة المعادن الانتقالية تتغير باستمرار.
- كتابة اسم المعدن ثم رقم الشحنة بالرموز اليونانية (I/ II/ III).
- كتابة اسم اللافلز وهو الأنيون متبوعًا بالمقطع (ide)، حيث دائمًا ما يكتب الأنيون متبوعًا بذلك المقطع.
تسمية المركبات الأيونية متعددة الذرات
لتسمية المركبات الأيونية التي تحتوي ذرتين أو أكثر يجب اتباع الخطوات الآتية:
- كتابة صيغة المركب الأيوني بالرموز، ويجب أن يحتوي على فلز واحد وباقي الذرات من اللافلزات.
- إيجاد الشحنة للذرات الموجودة في المركب.
- كتابة اسم الفلز متبوعًا بقيمة شحنته بالرمور اليونانية.
- كتابة أسماء الأيونات الأخرى عبر التأكد منها من الجدول الدوري.
أمثلة متنوعة على صيغ المركبات الأيونية
فيما يأتي بعض الأمثلة على صيغ المركبات الأيونية التي تختلف في خصائصها :
| المركب | اسم المركب | الكاتيون | الأنيون |
| NaCl | كلوريد الصوديوم (sodium chloride ) | Na | Cl- |
| Li 3 N | نتريد الليثيوم (lithium nitride) | Li | N |
| MgO | أكسيد المغنيسيوم (magnesium oxide) | Mg2 | O |
| Ca 3 P 2 | فوسفيد الكالسيوم (calcium phosphide) | Ca2 | P-3 |
| Na 2 SO 4 | كبريتات الصوديوم (sodium sulfate) | Na | SO 4 )) |
| NH 4 SCN | ثيوسيانات الأمونيوم (ammonium thiocyanate) | NH4 | SCN- |
| KOH | هيدروكسيد البوتاسيوم (potassium hydroxide) | K | OH- |
| (NH 4 )2CO 3 | كربونات الأمونيوم (ammonium carbonate) | NH | CO 3 )) |