ما هو عدد افوجادرو
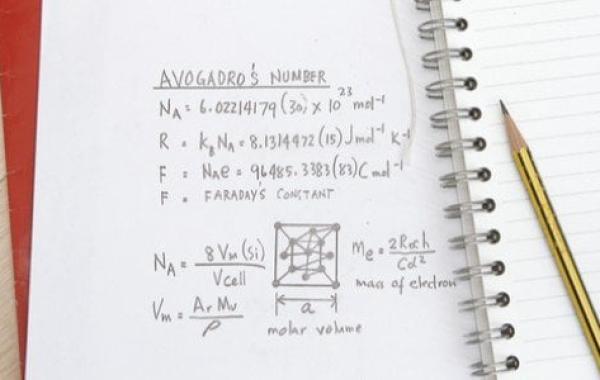
تعريف عدد أفوجادرو
يُمثّل عدد أفوجادرو (بالإنجليزية: Avogadro Number) عدد الجسيمات في مول واحد من أيّ مادة، ووحدته 1-^mol، ويساوي (6.02214076 × 10)، حيث يُستخدم لتحديد عدد الجسيمات باختلاف أشكالها: إلكترونات، أو ذرات، أو أيونات، أو جزيئات، وهذا يعتمد على طبيعة المادة.
سبب اختيار الكربون-12 كمقياس
يعود سبب اختيار الكربون -12 كمقياس لعدد أفجادرو لأنّه يقبل القسمة على 12، بحيث يكون عددًا صحيحًا من ذرات الكربون-12 مساويًا لكتلة الجرام الواحد، وبما أنّ عدد أفجادرو يُمثّل عدد الذرات في المول الواحد، وإذا كان مول واحد من الكربون يساوي 12 غرام، إذن فعدد أفجادرو يساوي عدد الذرات الموجودة في 12 غرام من الكربون-12.
كيفية حساب عدد الذرات في المركب باستخدام عدد أفوجادرو
يُمكن اتّباع الخطوات الآتية لحساب عدد ذرات مركب أو ذرة ما باستخدام قانون عدد الذرات :
- أولًا: إيجاد كتلة الذرة أو المركب، وتحويلها إلى وحدة الجرام، وبالعادة تكون معطاة بالسؤال.
- ثانيًا: إيجاد عدد المولات لهذا المركب، عن طريق قسمة الكتلة التي تمّ إيجادها على الكتلة المولية، ويُذكر أنّ الكتلة المولية موجودة في الجدول الدوري.
- ثالثًا: بعد الحصول على عدد المولات، تُضرب عدد مولات المركب أو الذرة بعدد أفوجادرو (6.02214076 × 10) للحصول على عدد ذرات هذا المركب بوحدة atoms.
حساب عدد الذرات في المركب باستخدام عدد أفوجادرو
احسب عدد ذرات جزيء الماء H2O، إذا علمت أنّ كتلته 14.7 جرام، علمًا بأن الكتلة المولية للأكسجين=16، للهيدروجين=1.
الحل:
- بما أنّ كتلة جزيء الماء معطاة في السؤال بوحدة الغرام، إذن يجب إيجاد الكتلة المولية له حسب القانون:
- الكتلة المولية للجزيء = (الكتلة المولية للهيدروجين× عدد ذراته الكتلة المولية للأكسجين× عدد ذراته)
- الكتلة المولية للجزيء = 1 ×2 16 ×1 = 18جرام/ مول
- عدد المولات = الكتلة / الكتلة المولية
- 14.7\18 = 0.8166 مول
- لإيجاد عدد ذرات جزيء الماء تُضرب عدد مولات الماء بعدد أفوجادرو:
- 0.8166 × 6.02214076 × 10 = 4.91808 × 10 atoms
قانون أفوجادرو للغازات
ينص قانون أفوجادرو للغازات على أنّ الغازات المتساوية في الحجم تحتوي على نفس عدد الجزيئات، أيًا كان نوع الغاز، وذلك عند نفس درجة الحرارة والضغط، ويُمكن التعبير عن ذلك رياضياً كالآتي:
V1 / n1 = V2 / n2
حيث إنّ:
- V1: الحجم الأولي للغاز.
- V2: الحجم النهائي للغاز.
- n1: عدد المولات الأولي للغاز.
- n2: عدد المولات النهائي للغاز.
مسائل حسابية على قانون أفوجادرو
فيما يأتي بعض الأمثلة التطبيقية على قانون أفوجادرو:
تمّ تعبئة بالون ب 2.30 لتر من غاز الهيليوم، عدد مولاته 0.0920 مول، ثمّ أُضيف 0.0210 مول من الهيليوم الإضافي إلى البالون مع ثبات درجة الحرارة والضغط، فما هو الحجم الجديد للبالون؟
الحل:
- بما أنّ درجة الحراة والضغط ثابتان، فيكون التطبيق على القانون الآتي:
- V1 / n1 = V2 / n2
- ذُكر بالسؤال أنّه أُضيف عدد من المولات على عدد المولات الأصلي، لذلك، n2 = n1 0.0210
- يكون التطبيق من خلال التعويض المباشر، حيث: V1 = 2.30 ، n1 = 0.0920 ، n2 = 0.113، أما V2 مجهولة، وبالتعويض بالقانون ينتج:
- 0.0920 / 2.30 = V2 / 0.113
- V2 = 2.825
- الحجم الجديد للبالون يساوي 2.825 لتر.
إذا كان لديك 6.00 لترات من الغاز ما، تحتوي على 0.743 مول من الجزيئات، كم سيكون الحجم الجديد للغاز إذا أصبح عدد المولات 1.852 مول، بافتراض ثبات الضغط ودرجة الحرارة؟
الحل:
- بما أنّ درجة الحراة والضغط ثابتان، فيكون التطبيق على القانون الآتي:
- V1 / n1 = V2 / n2
- 0.743 / 6.00 = V2 / 1.852
- الحجم النهائي للبالون= 14.95558 لتر.
تحتوي اسطوانة على 12.8 لتر من غاز ما، عدد مولاته 0.000498 مول، ما الحجم الذي يملؤه 0.0000136 مول من الغاز نفسه، عند درجة حرارة ودرجة ضغط ثابتتين؟
الحل:
- بما أنّ درجة الحراة والضغط ثابتان، فيكون التطبيق على القانون الآتي:
- V1 / n1 = V2 / n2
- 0.000498 / 12.8 = V2 / 0.0000136
- الحجم النهائي للبالون= 0.34955 لتر.
غاز ما حجمه 5.79 لتر، عدد مولاته 2.3087، أضيف إليه 1.5 لتر من نفس الغاز، كم يصبح عدد المولات بعد الإضافة، عند ثبات الحرارة والضغط؟
الحل:
- ذُكر بالسؤال أنه تمت إضافة 1.5 على حجم الغاز الأصلي، لذلك، V2 = V1 1.5
- يكون التطبيق من خلال التعويض المباشر، حيث V1 = 5.79 ، n1 = 2.3087 ، V2 = 7.29، أما n2 مجهولة
- بما أن درجة الحرارة والضغط ثابتان، فيكون التطبيق على القانون الآتي:
- V1 / n1 = V2 / n2
- عدد المولات النهائي = 18.2826 لتر.
عدد أفوجادرو هو رقم كبير جدًا قيمته 6.02214076 × 10، ، حيث يُمثّل عدد الجسيمات في مول واحد من المادة، ويُمكن استخدام عدد أفجادرو في الكثير من الحسابات الكيميائية كحساب الكتلة لمركب ما أو حساب عدد الذرات أو المولات.