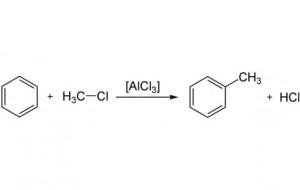
تفاعلات الاتحاد أو الضم يمكن يعريف تفاعلات الاتحاد أو الضم (بالإنجليزية: Synthesis) بأنّها عملية إنتاج مادّة من اتحاد موادّ مختلفة، حيث يتم تحويل المتفاعِلات إلى نواتج في عمليّة تسمّى التفاعل الكيميائي، فمثلاً عندما يتّحد عنصر الحديد (رمزه: Fe) مع عنصر الكبريت (رمزه: S) يتمّ إنتاج كبريتيد الحديد (رمزه: FeS)، ويمكن كتابة تلك المعادلة بالشكل الآتي: (Fe(s) S(s) → FeS(s، حيث تدلّ علامة الجمع على تفاعل الحديد مع الكبريت، ويدلّ السهم على إنتاج كبريتيد الحديد من هذا التفاعل، مع تعيين حالة الموادّ
البولي إيثيلين عالي الكثافة يُعتبر البولي إيثيلين عالي الكثافة (بالإنجليزية: High-Density Polyethylene) من أنواع البلاستيك شبه المرنة، والذي يمكن معالجتها بسهولة عن طريق البلمرة المحفّزة في المحاليل أو الغازات، ويتميّز هذا النوع من البلاستيك بمقاومته للمواد الكيميائية، والرطوبة، والتأثيرات الخارجية، إلّا أنّه لا يتحمّل درجات الحرارة التي تتجاوز 160 درجة مئوية، ويُمكن تلوين هذا النوع من البلاستيك بألوان مختلفة، كما يُمكن استخدامه لتخزين المواد الغذائية والمشروبات؛ لذلك يتمّ تصنيع أكياس التسوّق،
أنواع أكاسيد الحديد تنتج أكاسيد الحديد من كبريتات الحديد التي تتعرض لعدّة عوامل متتالية كالتّمريغ بالحرارة، وإزلة الماء، والتحلل، والغسيل، والتّرشيح، والتّجفيف، والطحن، بحيث تنتج بعدّة ألوان يتم تميزها من درجات تقنية عن طريق المقارنة بينها، حيث يتم استخدام أكاسيد الحديد بهدف اكتساب اللون، وتُعدّ غير قابل للذوبان بالماء إلا بنسبة 1%، مع ذلك تكون قابل للذوبان في المعادن المُركّزة والأحماض، وتتعدد أنواع أكاسيد الحديد، ونذكر منها: أكسيد الحديد الأصفر: وهو أكسيد الحديد الحديديّ، والأكسيد المائيّ،
الأكسجين يعدّ الأكسجين العنصر الأكثر وفرةً في القشرة الأرضية، ويشكل حوالي 467100 جزء من المليون منها أي 46.6%، ويتواجد الأكسجين كمركب رئيسي لمعادن السيليكات من خلال اتحاده مع غيره من العناصر، كما يتواجد كمركب في الكربونات والفوسفات، ويستخدم الأوكسجين في المجالات الصناعية والطبية والتجارية، حيث يستخدم مع الأسيتيلين لقطع ولحام المعادن، وفي المستشفيات لتخفيف الأمراض التنفسية، وفي تصنيع المتفجرات وغيرها. السيليكون يعد ثاني أكثر العناصر شيوعاً في القشرة، ويشكل حوالي 267.900 جزءاً من المليون
أضرار غاز الهيليوم يلجئ البعض سواء كانو أطفال أو بالغيين إلى استنشاق غاز الهيليوم للحصول على أصوات مضحكة ، ويمكن أن يؤدي هذا الاستنشاق إلى حرمان الرئتين من الحصول على الأوكسجين، وبالتالي حدوث إغماء، كما يمكن أن يتسبب ذلك في حالات أشد خطورة مثل انسداد أي من القصبات الهوائية الرئيسة، كما أن استنشاق الهيليوم النقي يمكن أن يتسبب ببعض الأضرار الخطيرة أيضاً، وفي حالات استنشاق الهيليوم ينصح بنقل الشخص إلى منطقة جيدة التهوية، وتقديم التنفس الاصطناعي له في حال عدم قدرته على التنفس، وإذا ما كان الوضع
غاز الأمونيا هو غاز ذو رائحة قويّة، ولا لون له، وهو أخفّ من الهواء ويرمز له بالرمز الكيميائي (NH3)؛ وذلك لأنّه يتكون من ذرة نيتروجين وثلاث ذرات هيدروجين، ويتم تحضيره عن طريق تقطير الفحم، وهو يستخدم لتشغيل الآلات في المصانع الكبيرة بشرط أن تكون الآلة لا تحتوي على المعادن؛ لأنّ هذا الغاز يسبّب الصدأ بسرعة. كان يُستخدم غاز الأمونيا سابقاً في المكيّفات إلا أنه في الوقت الحالي لم يعد مستخدماً في التكييف نظراً لأنّه سام، وتمّ استبداله بمادة الفريون، وهو يذوب في الماء بسرعةٍ شديدة، وهنا يصبح مفعوله
أضرار غاز CO2 الاختناق عندما يتمّ إطلاق غاز ثاني أكسيد الكربون في منطقة محصورة ولا يوجد فيها تهوية جيدة، فإنّ ذلك يؤدي إلى انخفاض تركيز الأكسجين، مما يُشكل خطراً على صحة الإنسان؛ لأنه يؤدي إلى صعوبة في التنفس، والاختناق. الإحساس اللاذع عندما يتمّ استنشاق غاز ثاني أكسيد الكربون بتراكيز عالية، فإنّ ذلك يؤدي إلى إحساس لاذع (بالإنجليزية: Stinging sensation) في الأنف، والحنجرة، وغالباً ما يُصاحب هذا التهيج الشعور بطعم حامض في الفم، وذلك بسبب ذوبان غاز ثاني أكسيد الكربون في الأغشية المخاطية، واللعاب
أضرار الهيدروجين القابلية للاشتعال أظهرت النتائج أنّ للهيدروجين قابلية كبيرة للاشتعال، بالإضافة إلى أنّ طاقة الإشعال التي يحتاجها تكون ضئيلة، وبالمقارنة مع البنزين والغاز الطبيعي فإنّ طاقة الاحتراق لهما تكون أكبر، ومن الجدير بالذكر أنّ احتمالية حدوث الحرائق تعتمد على عدة عوامل؛ وهي: نطاق القابلية للاشتعال، ودرجة حرارة الاشتعال التلقائي، والحد الأدنى من طاقة الاشتعال، وبما أنّ الطاقة التي يحتاجها الهيدروجين للاشتعال تكون قليلة، فإنّ خطره يكون أكبر. القابلية للانفجار يُمكن أن ينفجر الهيدروجين،
خطوات وزن المعادلة الكيميائية لوزن المعادلة الكيميائية يتم اتباع الخطوات الآتية: تحديد المواد المتفاعلة، والمواد الناتجة، وكتابة الصيغة الجزيئية لكل منهم. كتابة معادلة بحيث يتم وضع المواد المتفاعلة قبل السهم، والمواد الناتجة بعد السهم. حساب عدد الذرات لكل عنصر في المواد المتفاعلة، والمواد الناتجة. إذا كانت المعادلة غير موزونة فإنه يتم تغيير المُعامل الخاص بالجزيء حتى يصبح عدد الذرات لكل عنصر في المواد المتفاعلة مُساوياً لعدد الذرات في المواد الناتجة. التحقق من عدد الذرات للتأكد من أن المعادلة
أسماء مركبات كيميائيّة مع رموزها تتكوّن المركبات الكيميائيّة عند ارتباط ذرتين أو أكثر بروابط أيونيّة أو تساهميّة، أو مزيج من الرّوابط الأيونيّة والتّساهميّة، ومن الأمثلة على المركبات الكيميائيّة: ملح الطّعام ورمزه الكيميائي (NaCl)، والماء ورمزه الكيميائي (H2O)، وغاز ثاني أكسيد الكربون ورمزه الكيميائي (CO2)، وكربيد السّيليكون ورمزه الكيميائي (SiC)، وغيرها العديد. مركبات ترتبط بروابط أيونيّة تنشأ الرّابطة الأيونيّة بين ذرات تختلف في قدرتها على كسب وفقد الأيونات، ومن الأمثلة على مركبات ترتبط
أسماء المركبات الكيميائية شائعة الاستخدام هناك العديد من المركبات الكيميائية الشائعة، كما في الجدول الآتي: الاسم الشائع للمركب اسم المركب الكيميائي الصيغة الكيميائية صودا الخبز بيكربونات الصوديوم أو بيكربونات الصوديوم الهيدروجينية NaHCO3 المبيضات السائلة هيبوكلوريت الصوديوم أو بيروكسيد الهيدروجين H2O2 / NaClO المبيضات الصلبة بيربورات الصوديوم NaBO3 الملح الإنجليزي (Epsom Salt) كبريتات المغنيسيوم (magnesium sulfate heptahydrate) MgSO4.7H2O الفريون ثنائي كلورو ثنائي فلورو الميثان CF2Cl2 الغالينا
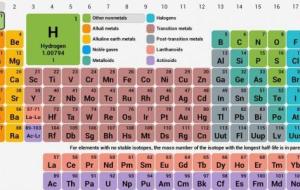
العناصر الكيميائيّة اقترنت العناصر الكيميائيّة الأساسية ببعض الحروف الهجائية التي سهّلت ترسّخها في العقل، حيث تعتبر هذه العناصر مكونات رئيسة لمختلف المواد الكيميائية من حولنا، سواء كانت كمكون منفرد أو كمكون مع عناصر أخرى. سنعرّج على أسماء هذه العناصر، كذلك المرور على بعض المعلومات المتعلّقة بتاريخها، مكتشفيها، وكيفية ترتيبها فيما يعرف بالجدول الدوري، كل ذلك وأكثر في السطور القادمة. تاريخ اكتشاف عناصر المادة وضع العالم الإنجليزي دالتون الحروف الهجائية كوسيلة تعبيرية للعناصر الكيميائية، وبعد ذلك
أسماء المركبات الكيميائية وصيغها فيما يلي قائمة بأبرز المركبات الكيميائية المألوفة والمستخدمة في حياتنا اليومية مرفوقة بصيغها الكيميائية وأسمائها العامة: مادة الكوارتز والاسم الكيميائي لها ثاني أكسيد السيليكون (SiO2). حليب المغنيسيا والاسم الكيميائي له هيدروكسيد المغنيسيوم (Mg(OH)2). الرخام والاسم الكيميائي له كربونات الكالسيوم (CaCO3). محاليل الصابون والاسم الكيميائي لها هيدروكسيد الصوديوم (NaOH). حجر الجير والاسم الكيميائي له كربونات الكالسيوم (CaCO3). غاز الضحك والاسم الكيميائي له أكسيد
الفضة أسرع المعادن توصيلاً للحرارة يُشار إلى الموصلية على أنّها قدرة المادة على نقل الطاقة، ويُعدّ معدن الفضة أسرع المعادن توصيلاً للطاقة الحرارية، ويعود السبب في هذا الأمر إلى حركة الإلكترونات الموجودة في معدن الفضة، إذ تتحرك هذه الإلكترونات بحرية كبيرة مقارنة مع تلك الموجودة في أيّ عنصر آخر، ولا تقتصر سرعة توصيل معدن الفضة على الطاقة الحرارية فحسب، وإنّما يُعدّ أكثر المعادن توصيلاً للطاقة الكهربائية كذلك، وأكثرها قدرة على عكس الضوء. خصائص معدن الفضة فيما يأتي أهم خصائص معدن الفضة تِبعاً
الكيمياء علم الكيمياء يهتم بدراسة المادة من حيث الخواص، والتركيبة، والبنية، والتفاعلات، والسلوك، والتداخلات التي تُحدثها، كما أنّ الكيمياء تربط علم الفيزياء بباقي العلوم الأخرى مثل: علم الجيلوجيا، وعلم الأحياء، وعلم الفلك، لذلك يُطلق عليها اسم "العلم المركزيّ"، تدرس الكيمياء التقليديّة الذرّات والجسيمات والمواد الكيميائيّة والجزيئات والبلّورات في جميع حالاتها سواءً الغازية أم الصلبة أم السائلة. الأدوات المستخدمة في مختبر الكيمياء ميزان كيميائي (The balance of chemical): ومنه عدّة أنواع تختلف
أدوات أساسية في مختبر الكيمياء يوجد كم هائل من الأدوات المُستخدمة في مختبر الكيمياء، ويمكن إجمال أهمها كما يلي: المجهر المركب: وهو أداة تستخدم عدسيتن لجعل الأجسام تبدو أكبر. أنبوب اختبار: يُستخدم لخلط، أو تسخين، أو حفظ المواد. حاملة أنابيب الاختبار: وهي لحمل أنابيب الاختبار. كأس زجاجي: يتسخدم الكأس الزجاجي في الإحتفاظ بالسوائل، وخلطها، وتسخينها. ملقط الكأس الزجاجي: يستخدم في التقاط الأكواب الزجاجية. صحن تبخير: وهو يُستخدم لتسخين السوائل للتبخر. ملقط: تتمثل وظيفته في التقاط أو مسك المواد
الأدوات الكيميائية توجد العديد من الأدوات الكيميائيّة التي يتم استخدامها مُباشرةً أثناء العمل في المُختبرات الكيميائيّة مثل: الميزان التحليلي Analytical Balance: يُطلق عليه أيضاً ميزان ميتلر، ويُستخدم هذا الميزان الرقمي لقياس الكُتلة بدقة 0.1 ملغ. جهاز الطرد المركزي Centrifuge: هو أداة تُستخدم لفصل مُكوّنات العيّنات السائلة عن طريق الدوران. الماصات Pipet: تُستخدم لقياس ونقل كميّات صغيرة من السائل، وهناك أنواع كثيرة منها. دوارق حجمية Volumetric Flask: تُستخدم هذه الدوارق لإعداد وتحضير المحاليل
أدوات قياس حجم الأجسام الصلبة تعرف الأجسام الصلبة بأنها أجسام ذات شكل وحجم ثابتين، وتقسم الأجسام الصلبة من حيث الشكل إلى جزئين: منتظمة الشكل و غير منتظمة الشكل. الأجسام الصلبة منتظمة الشكل يمكن قياس حجم الأجسام الصلبة منتظمة الشكل من خلال قياس أبعادها الثلاثة، ثم حساب الحجم حسب قوانين الحجم المعروفة، فمثلاً يمكن قياس حجم مكعب من خلال قياس طوله وعرضه وارتفاعه ثم حساب حجمه، حيث إن حجم المكعب هو ناتج ضرب الطول بالعرض بالارتفاع. الأجسام الصلبة غير منتظمة الشكل يمكن قياس حجم الأجسام الصلبة غير
المختبر يُعرَّف المختبر بأنه المكان الذي تتم فيه عمليات التحليل، والاستقصاء، واختبار النظريات وتطبيقها، وتحويل المفاهيم المجردة ملموسة، وفق إرشادات واستراتيجيات محددة للعمل فيه، كما أنه البيئة التي توفر للطلبة في صفوفهم المخبرية فرصة اكتشاف الأساليب التي استُخدمت من قبل العلماء في مجالاتهم التخصصية، وتتضمن هذه الصفوف أهدافاً مختلفة كتنمية التفكير النقدي الكمي، والمهارات التجريبية، ومهارات تحضير التقارير الشفوية والمكتوبة، والتعاون في حل المشكلات، إضافةً إلى تعلم كيفية استخدام الأجهزة العلمية،
الدورق الحجمي يُعد الدورق الحجمي (بالإنجليزية: Volumetric flasks) من أنواع الأوعية الزجاجية التي تُستخدم في المختبرات، ويستخدم لقياس السوائل، وهو أكثر دقة من الأوعية الأخرى؛ حيث إنه يستوعب كميات دقيقة من السائل؛ فمثلأ إذا كان حجم الدورق 500 مل فإنه يتسع ل 500 مل فقط، وليس أكثر، ومن الجدير بالذكر أن الدورق الحجمي يُستخدم بكثرة من قبل الكيميائيين، وذلك لأن التفاعلات الكيميائية تتطلب استخدام كميات دقيقة من المواد الكيميائية. موقد بنزن يُعرف موقد بنزن (بالإنجليزية: Bunsen burners) بأنه عبارة عن
المجهر يعد المجهر (بالإنجليزية: Microscope) من أهمّ مكونات المختبرات ، حيث تسمح المجاهر لمستخدمها رؤية الأشياء الصغيرة التي يصعب رؤيتها بالعين المجردة، فقد كانت المجاهر الأولى قديماً قادرة على تكبير حجم الجسم بمقدار 3-9 مرات، أمّا اليوم تستطيع المجاهر الحديثة تكبير الجسم آلاف المرات، كما تُمكّن المجاهر مستخدميها من رؤية البُنى الداخلية للأجسام، كمكونات الخلية والجراثيم. الميزان وهناك عدة أنواع من الموازين يُمكن استخدامها في المختبرات، مثل: ميزان الشعاع الثلاثي: (بالإنجليزية: Triple Beam
الدورق يُستخدم الدورق (بالإنجليزية: Beaker) لقياس حجم السوائل، ويوجد بأحجامٍ مختلفةٍ، ولا يعتبر أداة دقيقة للقياس؛ حيث تصل درجة الدقة لهذا الدورق إلى 10% فقط، أي أن الدورق الذي يكون حجمه لتراً سوف يقيس بدقة حتى 100 مل من حجم السائل، ومن الجدير بالذكر أن قاع الدورق يكون مُسطَّح الشكل، وذلك ليسهل وضعه على منضدة المختبر، بالإضافة إلى احتوائه على فتحة مخصصة لصب السوائل، ويتميز الدورق بأن له فُتحة واسعة، وهذا يجعل من السهل إضافة المواد أو خلطها في الدورق. الدورق المخروطي يتميز الدورق المخروطي
الموائع المائع هو عبارة عن مادة تتكون من مجموعة من الجزيئات المرتبة ترتيباً عشوائياً بحيث تكون قوى الترابط بين هذه الجزيئات ضعيفة، ويتميز المائع بأن له القدرة على التأثر بسهولة بالقوى الخارجية المؤثرة عليه من جوانب الإناء الذي يحتويه أو حتى من خارج الإناء، لذلك لا يمكن القول بأن له شكلاً محدداً، ومن الأمثلة على الموائع الهواء، والماء، والدم، كما أنّ له أهمية كبيرة في علم الفيزياء، بسبب دوره في العديد من التطبيقات الواسعة في الحياة، مثل: صناعة السفن، والسدود، والغواصات، والمضخات، وكذلك أجهزة
أثقل المواد حسب الكثافة الأوزميوم يُعدّ معدن الأوزميوم أكثر المعادن كثافة، حيث تبلغ كثافته 22.6 غم/مل، ويمتاز بالخمول الكيميائي، والمتانة، والصلابة، ويُستخدم في صناعة المماسات الكهربائية، وإبر الفونوغراف، وأقلام الحبر القابلة للتعبئة، وهو أكثر العناصر ندرة على وجه الأرض مما يجعل ثمنه مرتفعاً للغاية الذي قد يصل إلى 935 دولار للأوقية، ومن الجدير بالذكر أنّه عندما يتفاعل مع 4 ذرات من الأكسجين فإنه يكون رباعي أكسيد الأوزميوم، وهو مادة سامة للغاية. الإيريديوم يُعدّ معدن الإيريديوم ثاني أكثر المعادن